题目内容
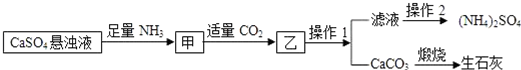
18.高纯氧化钙是用于电子工业重要的无机化工原料.用硝酸钙溶液制备高纯氧化钙的工艺流程如下:
下列说法中不正确的是( )
| A. | 反应池中的化学方程式为:CO2+2NH3•H2O+Ca(NO3)2═2NH4NO3+CaCO3↓ | |
| B. | 操作A为蒸发结晶 | |
| C. | 该工艺流程中可以循环使用的物质是CO2 | |
| D. | 冷却需在干燥的环境中进行,否则制得的高纯氧化钙中会混有杂质Ca(OH)2 |
分析 本题是酸碱盐的应用中的物质的制备,由题目的信息可知:冷却需在干燥的环境中进行,否则制得的高纯氧化钙中会混有杂质Ca(OH)2,因为氧化钙与水反应生成氢氧化钙;制备高纯氧化钙的工艺流程中生成的沉淀是CaCO3,因为氨水和二氧化碳和硝酸钙反应生成了碳酸钙白色沉淀和硝酸铵;该工艺流程中可以循环使用的物质是CO2.
解答 解:A、反应池中是氨气、水、二氧化碳和硝酸钙反应生成了硝酸铵和碳酸钙沉淀,其反应的化学方程式为:CO2+2NH3•H2O+Ca(NO3)2═2NH4NO3+CaCO3↓,正确;
B、操作A是过滤,不是蒸发,错误;
C、该工艺流程中可以循环使用的物质是CO2,正确;
D、冷却需在干燥的环境中进行,否则制得的高纯氧化钙中会混有杂质Ca(OH)2,因为氧化钙与水反应生成氢氧化钙,正确;
故选B.
点评 本考点属于实验题中的物质的制备题,综合性比较强,需要掌握酸碱盐的性质,还要掌握相互之间的反应规律和反应的条件.如果物质没有那种性质,就不能造实际上不存在的化学反应.还要注意根据题目给出的信息判断,各有什么注意事项,要把握好.本考点主要出现在实验题和选择题中.

练习册系列答案
相关题目
4.日常生活中的下列做法可行的是( )
| A. | 将鲜奶发酵制成酸奶 | B. | 在家具生产过程中大量使用甲醛 | ||
| C. | 将燃气热水器安装在浴室内 | D. | 用NaNO2溶液浸泡海鲜,防止变质 |
13.汽车安全气囊中装有叠氮化钠(NaN3)等固体粉末.工业上将金属钠与无水的液氨(NH3)反应得氨基钠(NaNH2),再将氨基钠与一氧化二氮反应可生成叠氮化钠、氢氧化钠和氨气.下列说法中,不正确的是( )
| A. | 安全气囊中选用叠氮化钠的原因可能是NaN3迅速分解产生大量NH3 | |
| B. | 钠可与水反应 | |
| C. | 制备叠氮化钠反应中,主要涉及的化学方程式为:Na+NH3 $\frac{\underline{\;\;△\;\;}}{\;}$NaNH2+H2↑ 2NaNH2+N2O$\frac{\underline{\;\;△\;\;}}{\;}$NaN3+NaOH+NH3↑ | |
| D. | 工业级NaN3中可能含有Na2CO3 |
7.某同学把自制的一种黄色花汁,分别滴加到下列不同的试剂中,并记录观察到的现象如表所示.
请分析上表,并回答下列问题:
(1)该花汁可以(填“可以”或“不可以”)作酸碱指示剂.
(2)蚊子叮咬人时射入蚁酸(具有酸的性质),使皮肤红肿、痛痒.要缓解这种症状,简易可行的办法是在叮咬处涂抹上述试剂中的肥皂水.
(3)胃酸的主要成分是盐酸,胃舒平(主要成分Al(OH)3)和小苏打常用于治疗胃酸过多症,写出小苏打治疗胃酸过多症时的化学反应方程式NaHCO3+HCl═NaCl+H2O+CO2↑.
(4)石灰水暴露于空气中易变质,写出变质反应的化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O.
| 试剂 | 稀盐酸 | 食醋 | 蔗糖水 | 蒸馏水 | 肥皂水 | 烧碱溶液 | 石灰水 |
| 颜色 | 红 | 红 | 黄 | 黄 | 绿 | 绿 | 绿 |
(1)该花汁可以(填“可以”或“不可以”)作酸碱指示剂.
(2)蚊子叮咬人时射入蚁酸(具有酸的性质),使皮肤红肿、痛痒.要缓解这种症状,简易可行的办法是在叮咬处涂抹上述试剂中的肥皂水.
(3)胃酸的主要成分是盐酸,胃舒平(主要成分Al(OH)3)和小苏打常用于治疗胃酸过多症,写出小苏打治疗胃酸过多症时的化学反应方程式NaHCO3+HCl═NaCl+H2O+CO2↑.
(4)石灰水暴露于空气中易变质,写出变质反应的化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O.
8.学习中,我们可以发现或总结许多具有一定规律性的知识.下列有关描述中,正确的是( )
| A. | 酸使石蕊溶液变红,则能使石蕊溶液变红的物质一定是酸 | |
| B. | 有机化合物一定含有碳元素,则含有碳元素的化合物一定是有机化合物 | |
| C. | 物体吸收热量,内能增加,它的温度不一定升高 | |
| D. | 铁在潮湿的空气中易腐蚀,所以金属在潮湿空气中均易腐蚀 |