题目内容
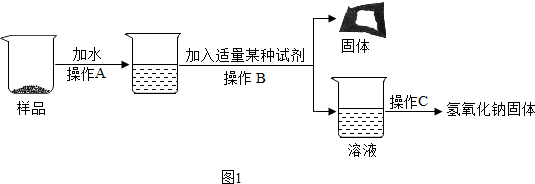
9.课本第十一单元课题1中,在学习“复分解反应发生的条件”的探究试验时,知道了CuSO4溶液和BaCl2溶液能发生反应,某实验小组对CuSO4溶液和BaCl2溶液反应后,所得溶液中溶质的成分进行探究,请你一同探究并回答下列问题.【查阅资料】:①CuCl2溶液、CuSO4溶液都呈蓝色,Cu(OH)2蓝色沉淀.
②CuSO4+BaCl2═BaSO4↓+CuCl2,BaSO4白色沉淀,不溶于水和盐酸.
【提出问题】:滤液中的溶质是什么物质?
【猜想假设】:甲同学认为:只含有CuCl2;
乙同学认为:一定含有CuCl2,可能含有CuSO4;
丙同学认为:一定含有CuCl2,肯能含有CuSO4和BaCl2
你认为:一定含有CuCl2,可能含有BaCl2.
【分析讨论】:丁同学认为丙同学的猜想肯定是不合理的,理由是CuSO4和BaCl2会继续发生反应.
【实验设计】:请你设计一个简单的实验来验证的猜想是正确的.
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中,逐渐滴加稀硫酸 | 产生白色沉淀 | 猜想正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中滴加少量的氢氧化钠溶液 | 产生蓝色沉淀 | 猜想正确 |
【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否完全反应.
分析 【猜想假设】根据硫酸铜和氯化钡前完全反应,也可能氯化钡或硫酸铜过量进行分析;
【实验设计】根据氯化钡好稀硫酸反应会生成白色的硫酸钡沉淀进行分析;
根据铜离子好氢氧根离子反应会生成氢氧化铜沉淀进行分析;
【反思拓展】根据在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否完全反应进行分析.
解答 解:【猜想假设】硫酸铜和氯化钡前完全反应,也可能氯化钡或硫酸铜过量,所以我的猜想是:一定含有氯化铜,可能含有氯化钡;
【实验设计】氯化钡好稀硫酸反应会生成白色的硫酸钡沉淀,所以
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中,逐渐滴加稀硫酸 | 产生白色沉淀 | 猜想正确 |
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否完全反应.
故答案为:【猜想假设】CuCl2,BaCl2;
【实验设计】
| 实验步骤 | 实验现象 | 实验结论 |
| 逐渐滴加稀硫酸 | 产生白色沉淀 |
【反思拓展】反应物是否完全反应.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的提示进行解答.

练习册系列答案
相关题目
14.下列变化属于化学变化的是( )
| A. | 蜡烛熔化 | B. | 铁水铸锅 | C. | 纸张燃烧 | D. | 海水晒盐 |
14.同学们在学习Ca(OH)2的化学性质时,对Ca(OH)2溶液和Na2 CO3溶液反应后溶液中溶质的成分进行探究.请你一同探究并回答下列问题:
【提出问题】滤液中的溶质是什么物质?
【查阅资料】①Ca(NO3)2溶液呈中性. ②Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3
【猜想假设】甲同学认为只含有NaOH;乙同学认为只含有NaOH,Ca(OH)2;丙同学认为含有NaOH、Ca(OH)2、Na2CO3;你认为可能含有NaOH和Na2CO3
【分析讨论】丁同学认为丙同学的猜想肯定是不合理的,理由是如果氢氧化钙和碳酸钠同时存在时会发生化学反应.
【实验设计】请你设计一个简单的实验来验证你的猜想是正确的.
甲同学也针对自己的猜想进行了如下实验.
你认为甲同学的实验结论是否正确?不正确(填“正确”或“不正确”),理由是如果含有NaOH和Ca(OH)2时或含有NaOH和Na2CO3时,滴加少量的稀盐酸时也是无明显现象.
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余.
【提出问题】滤液中的溶质是什么物质?
【查阅资料】①Ca(NO3)2溶液呈中性. ②Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3
【猜想假设】甲同学认为只含有NaOH;乙同学认为只含有NaOH,Ca(OH)2;丙同学认为含有NaOH、Ca(OH)2、Na2CO3;你认为可能含有NaOH和Na2CO3
【分析讨论】丁同学认为丙同学的猜想肯定是不合理的,理由是如果氢氧化钙和碳酸钠同时存在时会发生化学反应.
【实验设计】请你设计一个简单的实验来验证你的猜想是正确的.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液于试管中, 滴加足量的硝酸钙溶液,再滴入几滴酚酞试液 | 出现白色沉淀,酚酞试液变红色 | 猜想正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,滴加少量的稀盐酸 | 无明显现象 | 猜想正确 |
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余.
1.物质甲和乙完全燃烧生成物质丙和丁,各物质的微观示意图如表所示.
下列说法错误的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |  |
| 分子示意图 |  |  |  |  |
| A. | 甲物质属于有机物 | |
| B. | 该反应属于置换反应 | |
| C. | 反应后元素的种类不变 | |
| D. | 该反应的化学方程式为:C2H4+302 $\frac{\underline{\;点燃\;}}{\;}$2C02+2H20 |
18. 在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:
在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:
小萌同学通过探究发现,此包装袋中的生石灰干燥剂已经完全变质失效.他采用的探究方法是:取少量样品于试管中,加入少量水,用手触摸试管外壁,没有明显的放热现象.此实验中加入的水必须是少量的,理由是如果所加的水较多,则水会吸收反应产生的热量,影响实验的结论.
【查阅资料】
石灰干燥剂的成分为CaO,请写出该干燥剂干燥原理CaO+H2O=Ca(OH)2(用化学方程式表示).
【提出猜想】①该干燥剂的成分为Ca(OH)2
②该干燥剂的成分为CaCO3
③你的猜想是CaCO3、Ca(OH)2;
【方案设计】小组成员设计了如下的实验方案:
方案一:取样滴加稀盐酸,有气泡产生,则白色固体只存在CaCO3;
方案二:取样滴加少量稀盐酸,没有气泡产生,则白色固体中只存在Ca(OH)2;
方案三:取样加入水中,振荡,静置,上层为清液,下层出现固体不溶物,取上层清液滴加酚酞试液,变红,则固体为CaCO3和Ca(OH)2的混合物.
【实验分析】小组成员经过讨论发现上述实验方案都存在着问题.
(1)上述方案一中存在的问题是不能说明白色固体中是否含有Ca(OH)2.
(2)上述方案二的结论是错误的,原因是由于加入的盐酸是少量的,可能只是与氢氧化钙发生了反应,还没有与碳酸钙反应,无法证明没有碳酸钙的存在.
(3)实验方案三中的结论也有些不妥,是因为不能说明白色固体中含有CaCO3,因为不溶物可能是微溶于水的氢氧化钙.
(4)实验证实,该固体是CaCO3和Ca(OH)2的混合物,请你再设计一种实验方案予以证明,只要写出实验步骤和现象即可.
【数据分析】
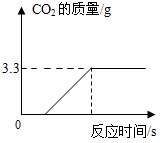
为了进一步确定该混合物中CaCO3的质量分数,实验小组的同学取了15克样品,加入足量的稀盐酸,实验测得生成CO2气体的质量如图所示,请据图计算该混合物中CaCO3的质量分数.
【反思与评价】
实验中造成计算结果与实际值相比偏小,则可能的原因是有部分生成的二氧化碳气体因溶解于水而没有全部逸出.
 在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:
在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:小萌同学通过探究发现,此包装袋中的生石灰干燥剂已经完全变质失效.他采用的探究方法是:取少量样品于试管中,加入少量水,用手触摸试管外壁,没有明显的放热现象.此实验中加入的水必须是少量的,理由是如果所加的水较多,则水会吸收反应产生的热量,影响实验的结论.
【查阅资料】
石灰干燥剂的成分为CaO,请写出该干燥剂干燥原理CaO+H2O=Ca(OH)2(用化学方程式表示).
【提出猜想】①该干燥剂的成分为Ca(OH)2
②该干燥剂的成分为CaCO3
③你的猜想是CaCO3、Ca(OH)2;
【方案设计】小组成员设计了如下的实验方案:
方案一:取样滴加稀盐酸,有气泡产生,则白色固体只存在CaCO3;
方案二:取样滴加少量稀盐酸,没有气泡产生,则白色固体中只存在Ca(OH)2;
方案三:取样加入水中,振荡,静置,上层为清液,下层出现固体不溶物,取上层清液滴加酚酞试液,变红,则固体为CaCO3和Ca(OH)2的混合物.
【实验分析】小组成员经过讨论发现上述实验方案都存在着问题.
(1)上述方案一中存在的问题是不能说明白色固体中是否含有Ca(OH)2.
(2)上述方案二的结论是错误的,原因是由于加入的盐酸是少量的,可能只是与氢氧化钙发生了反应,还没有与碳酸钙反应,无法证明没有碳酸钙的存在.
(3)实验方案三中的结论也有些不妥,是因为不能说明白色固体中含有CaCO3,因为不溶物可能是微溶于水的氢氧化钙.
(4)实验证实,该固体是CaCO3和Ca(OH)2的混合物,请你再设计一种实验方案予以证明,只要写出实验步骤和现象即可.
| 实验操作步骤 | 实验现象 |
| (1)取样,滴加足量稀盐酸 (2)另取适量的样品,加足量的水溶解,静置取上层清液,滴加酚酞试液 | (1)产生大量的气泡 (2)溶液呈红色 |
为了进一步确定该混合物中CaCO3的质量分数,实验小组的同学取了15克样品,加入足量的稀盐酸,实验测得生成CO2气体的质量如图所示,请据图计算该混合物中CaCO3的质量分数.
【反思与评价】
实验中造成计算结果与实际值相比偏小,则可能的原因是有部分生成的二氧化碳气体因溶解于水而没有全部逸出.
19.下列有关物质的化学式、名称及俗名不完全一致的是( )
| A. | NaCl 氯化钠 食盐 | B. | CaO 氧化钙 熟石灰 | ||
| C. | Na2CO3 碳酸钠 纯碱 | D. | NaOH 氢氧化钠 烧碱 |