题目内容
10.上课前,老师在实验室准备几瓶氧气,当所称取的7.9g高锰酸钾固体粉末在大试管中受热分解到不再产生气体时,将试管冷却至室温后,称量剩余固体质量为7.1g.计算回答下列问题:(1)反应所产生氧气的质量;
(2)剩余固体中二氧化锰的质量.
分析 高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应前后的质量差即为反应生成氧气的质量,根据氧气的质量可以计算二氧化锰的质量.
解答 解:(1)该同学制得氧气的质量是:7.9g-7.1g=0.8g,
(2)设剩余固体中二氧化锰的质量为x,
2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
87 32
x 0.8g
$\frac{87}{32}$=$\frac{x}{0.8g}$
x=2.175g
答:(1)反应所产生氧气的质量是0.8g;(2)剩余固体中二氧化锰的质量是2.175g.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
相关题目
1.甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示.下列叙述正确的是( )
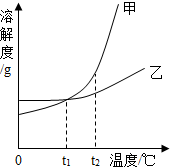

| A. | t1℃时,甲和乙溶液中溶质的质量分数一定相等 | |
| B. | t2℃时,分别用等质量的甲和乙固体,完全溶解配制成饱和溶液,得到乙溶液的质量大于甲 | |
| C. | 将甲、乙的饱和溶液从t1℃升温至t2℃,甲溶液中溶质的质量分数比乙大 | |
| D. | 使甲的不饱和溶液变成饱和溶液只能用降温的方法 |
5.下列方案设计中能够达到实验目的是( )
| A. | 用点燃的方法除去CO2中的CO | |
| B. | 用生石灰除去二氧化碳中的水蒸气 | |
| C. | 用水鉴别NH4NO3和NaOH固体 | |
| D. | 用硝酸银溶液鉴别氯化钠溶液和稀盐酸 |
2.下列有关青蒿素(化学式:C15H22O5)的说法不正确的是( )
| A. | 青蒿素是一种有机物 | B. | 青蒿素中氢、氧的质量比为11:40 | ||
| C. | 青蒿素中含有42个原子 | D. | 青蒿素中碳元素质量分数最大 |
19. 同学们来到化学实验室,意外看到了一个不和谐的“音符”(如图).由此,激发了同学们的探究欲望.
同学们来到化学实验室,意外看到了一个不和谐的“音符”(如图).由此,激发了同学们的探究欲望.
(1)同学们取该瓶中少量溶液滴加稀盐酸,看到冒气泡,说明药品已变质,变质反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O.
【进行猜想】小天的猜想:NaOH 溶液部分变质;
你的猜想:NaOH溶液全部变质.
【实验探究】小天设计如下实验来验证自己的猜想,请完成下表:
【实验反思】(1)下列物质1.BaCl2溶液 2.Ba(OH)2溶液 3.Ca(OH)2溶液4.Ca(NO3)2溶液,不能替代小天实验中CaCl2溶液的是2、3(填序号).
(2)小天第二次滴加的试剂除用指示剂外,还可以用CuSO4溶液替代.
 同学们来到化学实验室,意外看到了一个不和谐的“音符”(如图).由此,激发了同学们的探究欲望.
同学们来到化学实验室,意外看到了一个不和谐的“音符”(如图).由此,激发了同学们的探究欲望.(1)同学们取该瓶中少量溶液滴加稀盐酸,看到冒气泡,说明药品已变质,变质反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O.
【进行猜想】小天的猜想:NaOH 溶液部分变质;
你的猜想:NaOH溶液全部变质.
【实验探究】小天设计如下实验来验证自己的猜想,请完成下表:
| 探究步骤 | 预计现象 | 探究目的 |
| ①:取少量溶液于试管中,滴加足量的CaCl2试剂 | 出现白色沉淀 | 除尽溶液中的CO32- |
| ②:向实验①过滤后所得溶液中滴加酚酞试液 | 试液变红 | 证明溶液中尚存NaOH |
(2)小天第二次滴加的试剂除用指示剂外,还可以用CuSO4溶液替代.
20.复习课上,老师要求学生用不同的方法鉴别稀硫酸和氢氧化钠溶液,小东、小南两位同学取同一溶液分别进行如下实验:
【实验方案】
【提出问题】为什么我们取相同溶液而实验结论却不同呢?
【解决问题】小东、小南讨论后决定再用硫酸铜溶液进一步验证,结果观察到的现象是产生蓝色沉淀,于是一致认为该溶液是氢氧化钠溶液,为什么小南加入铝条会有气泡产生呢?通过查阅资料,他们发现初中常见金属中只有铝能与酸、碱反应,铝与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
【拓展延伸】利用老师要求鉴别的那两种溶液,测定镁铝铜合金中各成分的含量.实验设计如下:

【回答问题】
(1)写出操作Ⅰ中玻璃棒的作用:引流.
(2)a溶液是氢氧化钠溶液.
(3)金属铜的质量为0.5g,固体A含有的物质是镁和铜,溶液A中所含溶质是NaOH、NaAlO2.
【实验方案】
| 实验步骤 | 实验现象 | 实验结论 | |
| 小东 | 用玻璃棒蘸取溶液滴到pH试纸上,对照比色卡并读出pH | pH试纸变色 pH>7(填“>”或“<”) | 该溶液是氢氧化钠溶液 |
| 小南 | 取适量溶液于试管中,加入经打磨过的铝条 | 有气泡产生 | 该溶液是稀硫酸 |
【解决问题】小东、小南讨论后决定再用硫酸铜溶液进一步验证,结果观察到的现象是产生蓝色沉淀,于是一致认为该溶液是氢氧化钠溶液,为什么小南加入铝条会有气泡产生呢?通过查阅资料,他们发现初中常见金属中只有铝能与酸、碱反应,铝与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
【拓展延伸】利用老师要求鉴别的那两种溶液,测定镁铝铜合金中各成分的含量.实验设计如下:

【回答问题】
(1)写出操作Ⅰ中玻璃棒的作用:引流.
(2)a溶液是氢氧化钠溶液.
(3)金属铜的质量为0.5g,固体A含有的物质是镁和铜,溶液A中所含溶质是NaOH、NaAlO2.
