题目内容
17.提纯某KCl样品(含有少量MgCl2和K2SO4)的方案(所加试剂均过量)如下:样品$→_{①}^{加水}$溶液$→_{②}^{试剂A}$浊液$→_{③}^{K_{2}CO_{3}}$滤液$→_{④}^{盐酸}$溶液
回答下列问题:
(1)步骤①和③的实验操作均用到的玻璃仪器有烧杯和玻璃棒.
(2)步骤②通过加入某种试剂A便可同时除去两种杂质,得到的浊液中含有Mg(OH)2和BaSO4沉淀,写出生成BaSO4的化学方程式Ba(OH)2+K2SO4═BaSO4↓+2KOH.
(3)确定步骤③所加的K2CO3是否过量的方法是:在加入K2CO3后的浊液中取少量上层澄清液于试管,然后滴加K2CO3溶液,若无白色沉淀生成(填现象),则说明所加K2CO3已过量.
(4)经过步骤④得到溶液的成分为HCl、KCl(填化学式).若要得到KCl晶体,还要进行如下操作;将溶液倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到出现较多固体时(填现象),停止加热用余热使水分蒸干.
分析 (1)根据溶解、过滤时均用到的玻璃仪器有玻璃棒和烧杯进行分析;
(2)根据氢氧化钡和硫酸钾反应生成硫酸钡沉淀和氢氧化钾进行分析;
(3)根据氯化钡和碳酸钾反应能生成碳酸钡沉淀和氯化钾,该反应可以判断碳酸钾是否过量进行分析;
(4)根据提纯KCl样品的过程中加入的试剂及发生的反应分析步骤④得到溶液的成分,根据蒸发的正确操作分析回答停止加热的时间.
解答 解:(1)溶解、过滤时都要用到玻璃棒和烧杯;
(2)氢氧化钡和硫酸钾反应生成硫酸钡沉淀和氢氧化钾,化学方程式为:Ba(OH)2+K2SO4═BaSO4↓+2KOH;
(3)在加入K2CO3后的浊液中取少量上层澄清液于试管,然后滴加K2CO3溶液,若没有白色沉淀生成,则说明所加碳酸钾过量;
(4)由于所加的盐酸是过量的,步骤④得到的溶液的溶质除了KCl外,还含有盐酸,盐酸中的溶质是氯化氢,化学式是HCl,加热蒸发并用玻璃棒不断搅拌,直到出现较多固体时,停止加热,用余热使水分蒸干.
故答案为:(1)玻璃棒;
(2)Ba(OH)2+K2SO4═BaSO4↓+2KOH;
(3)无白色沉淀生成;
(4)HCl、KCl,出现较多固体.
点评 本题主要考查杂质的去除、化学方程式的书写、蒸发结晶等方面的知识,要注意蒸发结晶操作过程中,停止加热的时间要掌握好.

练习册系列答案
相关题目
7.铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上.铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因.请回答下列问题:
(1)铁生锈的主要条件是铁与空气中的氧气和水直接接触.
(2)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
上述三种金属的活动性由强到弱的顺序是Mg、Cr、Cu.
(1)铁生锈的主要条件是铁与空气中的氧气和水直接接触.
(2)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
| 金属 | Cr | Mg | Cu |
| 与盐酸反应现象 | 放出气泡速率缓慢 | 放出气泡速率较快 | 无明显现象 |
8.2007年诺贝尔化学奖授予德国化学家GerhardErtl,以表彰他在表面化学领域研究所取得的开拓性成就.某反应在Pt/Al2O3/Ba催化剂表面吸附与解吸作用的机理如图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),该机理研究是指( )
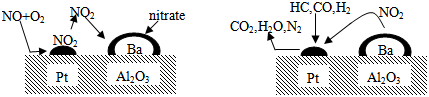

| A. | 催化剂参与反应活性研究 | B. | 金属变质机理 | ||
| C. | 汽车尾气催化转化处理 | D. | 氮气催化氧化机理 |
5.向100g饱和硫酸铜溶液中加入1.6g白色硫酸铜粉末,此时析出的晶体质量是( )
| A. | 2.5g | B. | 1.6g | C. | 大于2.5g | D. | 1.6~2.5g |
12.下列有关溶液的说法中正确的是( )
| A. | 一定温度下,某物质的饱和溶液中加入该物质,则溶液溶质质量分数一定增大 | |
| B. | 无色透明的液体一定是溶液 | |
| C. | 升高温度,物质溶解度不一定增大 | |
| D. | 25℃时,100 g物质的饱和溶液中含A25 g,则该物质的溶解度为25 g |
2.对于天宫一号目标飞行器内镍氢电池的总反应式H2+2NiO(OH)=2Ni(OH)2,下列叙述不正确的是( )
| A. | H2是单质 | |
| B. | Ni(OH)2中Ni化合价为+2价 | |
| C. | NiO(OH)是氧化物 | |
| D. | 参加反应的H2、NiO(OH)的质量比为1:92 |
9.某课外小组取一杯滴有红墨水的自来水,加入适量纳米二氧化钛,进行“污水变纯净水”的趣味实验.纳米二氧化钛是一种新型材料,在可见光下能促进有色物质降解为水和二氧化碳.据此推测,纳米二氧化钛在污水处理中可作( )
| A. | 吸附剂 | B. | 凝聚剂 | C. | 消毒剂 | D. | 催化剂 |
7.下列物质中属于纯净物的是( )
| A. | 洁净的空气 | B. | 液氧 | C. | 自来水 | D. | 米醋 |
 严谨的科学研究态度,善于在实验中发现问题、分析问题,
严谨的科学研究态度,善于在实验中发现问题、分析问题,