题目内容
12.学校实验小组验证反应原理,在室温为15℃时,同学们将10g氢氧化钠固体完全溶解溶于80g水中,而后匀速的通入二氧化碳气体.同时用传感器测定溶液的pH变化,同时用数据采集器记录并绘制图象如图2所示.
(1)图1所示实验中,用“分液漏斗”而不用“长颈漏斗”其原因是便于控制生成二氧化碳的速率;
(2)通过图象分析,小苏打溶液是显碱性(填“酸性”、“中性”或“碱性”),图象中M点处发生的主要化学反应方程式为2NaOH+CO2═Na2CO3+H2O;
(3)为了确定M处溶液的成分,同学们进行如下实验:
| 实验步骤 | 加入试剂 | 实验现象 | 初步实验结论 |
| ① | 滴入滴入无色酚酞 | 溶液变红 | 有既有氢氧化钠,又有碳酸钠物质 |
| ② | 加入加入过量的CaCl2溶液 | 有白色沉淀生成,且红色不消失 |
分析 (1)根据分液漏斗的作用进行分析;
(2)根据溶液的pH与溶液酸碱性的关系以及化学方程式的书写方法进行分析;
(3)先滴入无色酚酞试液,溶液变红,则溶液显碱性,再加入过量的 CaCl2溶液(显中性),有白色沉淀生成,且红色不消失,说明溶液中有碳酸钠和氢氧化钠,据此分析;
(4)溶液中溶解过量的二氧化碳后,二氧化碳与溶液中的碳酸钠反应,生成碳酸氢钠,碳酸氢钠在水中溶解度小,碳酸氢钠达到一定量时会析出,据此分析.
解答 解:(1)分液漏斗便于控制液体的滴入量,从而控制生成二氧化碳的速率;
(2)通过图象分析,小苏打溶液的pH大于7,显碱性;图象中M点处发生的主要化学反应是二氧化碳与氢氧化钠反应,反应方程式为2NaOH+CO2═Na2CO3+H2O;
(3)为了确定M处溶液的成分,先滴入无色酚酞试液,溶液变红,则溶液显碱性,再加入过量的 CaCl2溶液(显中性),有白色沉淀生成,且红色不消失,说明溶液中有碳酸钠和氢氧化钠;
(4)实验过程中,溶液中溶解过量的二氧化碳后,二氧化碳与溶液中的碳酸钠反应,生成碳酸氢钠,因为碳酸钠在水中溶解度大,碳酸氢钠在水中溶解度小,碳酸氢钠达到一定量时会析出.
故填:(1)便于控制生成二氧化碳的速率;(2)碱性;2NaOH+CO2═Na2CO3+H2O;(3)
| 滴入无色酚酞 | 既有氢氧化钠,又有碳酸钠 | ||
| 加入过量的 CaCl2溶液 | 有白色沉淀生成,且红色不消失 |
点评 此题难度不大,以实验为载体,考查了碱的化学性质和化学方程式的书写,同时又考查了学生利用课本知识结合新信息处理问题的能力.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
3.下列化学方程式,书写正确的是( )
| A. | 2Fe+6HCl═2FeCl3+3H2O | B. | Fe2O3+H2SO4═FeSO4+H2O | ||
| C. | Zn+2HCl═Zn(NO3)2+H2↑ | D. | Fe+H2SO4═FeSO4+H2↑ |
7.2016年世界地球日活动的主题为“节约集约利用资源,倡导绿色简约生活”,活动旨在唤起人类爱护地球,保护家园的意识,以促进资源开发与环境保护的协调发展,进而改善地球的整体环境,下列不符合该主旨的做法是( )
| A. | 禁止使用化石燃料 | B. | 垃圾分类回收处理 | ||
| C. | 合理开采和利用稀土资源 | D. | 保护地下水源 |
4.某氮的氧化物中,氮、氧元素质量比为7:4,则氧化物的化学式为( )
| A. | NO | B. | N2O | C. | N2O3 | D. | NO2 |

 ”和“
”和“ ”分别表示氧原子和氢原子,其中能保持水的化学性质的是( )
”分别表示氧原子和氢原子,其中能保持水的化学性质的是( )



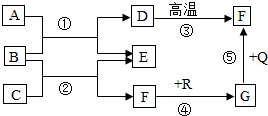 如图是初中化学中常见物质间的转化关系,其中,在通常情况下,E是生活中常用的调味剂、防腐剂,F、G是组成元素相同的两种气体,Q、R都是黑色固体(部分反应条件略去),试回答下列问题:
如图是初中化学中常见物质间的转化关系,其中,在通常情况下,E是生活中常用的调味剂、防腐剂,F、G是组成元素相同的两种气体,Q、R都是黑色固体(部分反应条件略去),试回答下列问题: