题目内容
15. 实验小组同学欲利用氢氧化钠溶液与硫酸探究中和反应中的热量变化.请你参与探究实验.
实验小组同学欲利用氢氧化钠溶液与硫酸探究中和反应中的热量变化.请你参与探究实验.(1)实验小组设计了如下方案:在装有20mL10%NaOH溶液的小烧杯中不断滴加质量分数为90%的浓硫酸,边滴边搅拌,并用温度计测量实验过程中烧杯内液体温度的变化情况,请你分析该实验方案中存在的不足之处,提出两点改进措施不足之处:利用了浓硫酸;改进方法:把浓硫酸改为稀硫酸、不足之处:边滴边搅拌;改进方法:一次性加入不搅拌.
(2)实验过程中发生反应的化学方程式是2NaOH+H2SO4═Na2SO4+2H2O.
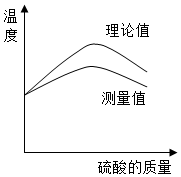
(3)如图为该反应中温度与滴加的硫酸质量变化关系的理论值和测量值的曲线比较情况.
①图示说明实验中测得的中和反应放出的热量比理论值低(填“高”或“低”).
②请指出造成理论值和测量值差异的一点原因没有采取隔热处理.
③图中温度达到最高值后降低的原因是完全反应后不再放热,继续加入稀硫酸时会降温,同时溶液散热.
(4)实验小组欲进一步探究氢氧化钠溶液与硫酸反应放热快慢的因素,你认为有哪些呢?请提出猜想,并设计实验.
猜想:与浓度有关
实验方案:实验步骤:在两支装有20mL10%的氢氧化钠溶液的小烧杯中分别同时滴加质量分数为5%、10%的稀硫酸各20mL,用温度计测量实验过程中烧杯内液体温度的变化情况;
实验现象:滴加10%的稀硫酸的烧杯内液体温度升高的快;
实验结论:反应物浓度越大,放热越快.
分析 (1)浓硫酸溶于水放热;
氢氧化钠和硫酸的反应过程中,边滴边搅拌会使溶液散热加快;
(2)实验过程中氢氧化钠和稀硫酸反应生成硫酸钠和水;
(3)根据图中信息可以判断相关方面的问题;
(4)反应物浓度越大,反应速率越快,放热或吸热也越快.
解答 解:(1)浓硫酸溶于水放热,因此不能确定温度升高是由于中和反应放热导致的,应该把浓硫酸换成稀硫酸,不足之处:利用了浓硫酸;改进方法:把浓硫酸改为稀硫酸;
如果边滴边搅拌,反应放出的热量容易散发出去,不足之处:边滴边搅拌;改进方法:一次性加入不搅拌.
故填:不足之处:利用了浓硫酸;改进方法:把浓硫酸改为稀硫酸;
不足之处:边滴边搅拌;改进方法:一次性加入不搅拌.
(2)实验过程中氢氧化钠和稀硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O.
故填:2NaOH+H2SO4═Na2SO4+2H2O.
(3)①图示说明实验中测得的中和反应放出的热量比理论值低.
故填:低.
②造成理论值和测量值差异的一点原因是没有采取隔热处理.
故填:没有采取隔热处理.
③图中温度达到最高值后降低的原因是完全反应后不再放热,继续加入稀硫酸时会降温,同时溶液散热.
故填:完全反应后不再放热,继续加入稀硫酸时会降温,同时溶液散热.
(4)猜想:与浓度有关;
实验方案:实验步骤:在两支装有20mL10%的氢氧化钠溶液的小烧杯中分别同时滴加质量分数为5%、10%的稀硫酸各20mL,用温度计测量实验过程中烧杯内液体温度的变化情况;
实验现象:滴加10%的稀硫酸的烧杯内液体温度升高的快;
实验结论:反应物浓度越大,放热越快.
故填:与浓度有关;实验步骤:在两支装有20mL10%的氢氧化钠溶液的小烧杯中分别同时滴加质量分数为5%、10%的稀硫酸各20mL,用温度计测量实验过程中烧杯内液体温度的变化情况;
实验现象:滴加10%的稀硫酸的烧杯内液体温度升高的快;
实验结论:反应物浓度越大,放热越快.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

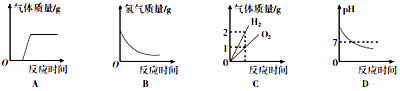
| A. | 向久置于空气中的NaOH溶液滴加盐酸 | |
| B. | 将锌块加入足量的稀硫酸中 | |
| C. | 电解水 | |
| D. | 向pH=9的NaOH溶液中不断加水 |
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 金刚石是由碳元素组成的单质 | 金刚石可用来切割玻璃 |
| B | 石墨有导电性 | 石墨可用于制铅笔芯 |
| C | 活性炭的吸附是化学变化 | 活性炭可作冰箱除味剂 |
| D | 碳有还原性 | 焦炭可以冶炼金属 |
| A. | A | B. | B | C. | C | D. | D |
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 加入NaOH溶液质量/g | 40 | 40 | 40 | 40 | 40 |
| 共生成沉淀的质量/g | 2.9 | 5.8 | m | 11.6 | 11.6 |
(2)恰好完全反应时,所得溶液中溶质的质量分数?
(3)固体混合物中NaCl的质量分数25.8%(结果保留一位小数)
| A. | 冰水 | B. | 泥水 | C. | 矿泉水 | D. | 牛奶 |
