题目内容
20.将25.6gNaCl和MgCl2固体混合物完全溶于126g水中配成溶液,再将200g一定溶质质量分数的NaOH溶液不断加入到该溶液中,充分反应后,测得的实验数据如表:| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 加入NaOH溶液质量/g | 40 | 40 | 40 | 40 | 40 |
| 共生成沉淀的质量/g | 2.9 | 5.8 | m | 11.6 | 11.6 |
(2)恰好完全反应时,所得溶液中溶质的质量分数?
(3)固体混合物中NaCl的质量分数25.8%(结果保留一位小数)
分析 根据前两次每次加入40g氢氧化钠溶液沉淀生成2.9g,而第四次依然是为2.9的四倍,所以第三次应该也是增加2.9g,故m=8.7g.根据氢氧化镁的质量和对应的化学方程式求算氯化镁和生成的氯化钠的质量,进而求算对应的质量分数.
解答 解:根据前两次每次加入40g氢氧化钠溶液沉淀生成2.9g,而第四次依然是为2.9的四倍,所以第三次应该也是增加2.9g,故m=8.7g.
第四次反应时恰好完全反应
设恰好完全反应生成氯化钠的质量为x,参加反应的氯化镁的质量为y.
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95 58 117
y 11.6g x
$\frac{95}{y}$=$\frac{58}{11.6g}$=$\frac{117}{x}$
x=23.4g
y=19g
恰好完全反应时,所得溶液中溶质的质量分数为$\frac{25.6g-19g+23.4g}{25.6g+40g×4-11.6g}$×100%=10%
固体混合物中NaCl的质量分数为$\frac{25.6g-19g}{25.6g}$×100%≈25.8%
答:(1)表中m的值为 8.7.
(2)恰好完全反应时,所得溶液中溶质的质量分数为10%.
(3)固体混合物中NaCl的质量分数 25.8%
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
11.下列图中涉及到的能源不属于新能源的是( )
| A. |  氢能源客车 | B. |  太阳能路灯 | C. |  风能发电 | D. |  石油钻井平台 |
12.下列说法正确的有( )
| A. | 在一定量的溶剂里,食盐的饱和溶液比它的不饱和溶液要浓 | |
| B. | 浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液 | |
| C. | 20℃时的硝酸钾饱和溶液,当温度升高到60℃时,其它条件不变,该溶液还是饱和溶液 | |
| D. | 对同一溶质的溶液而言,在一定温度下,饱和溶液比不饱和溶液要浓 |

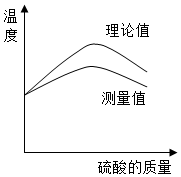 实验小组同学欲利用氢氧化钠溶液与硫酸探究中和反应中的热量变化.请你参与探究实验.
实验小组同学欲利用氢氧化钠溶液与硫酸探究中和反应中的热量变化.请你参与探究实验.