题目内容
4.用化学用语表示:(1)两个汞原子2Hg;(2)氧化铝中铝元素的化合价$\stackrel{+3}{Al}$2O3;
(3)3个亚铁离子3Fe2+;(4)保持干冰化学性质的最小粒子CO2.
分析 书写元素符号时,第一个字母要大写,第二个字母要小写;化学符号周围的数字表示不同的意义:符号前面的数字,表示原子、离子或分子个数;右上角的数字表示一个离子所带的电荷数;右下角的数字表示几个原子构成一个分子;元素正上方的数字表示元素的化合价.两个汞原子表示为2Hg,氧化铝中铝元素的化合价表示为$\stackrel{+3}{Al}$2O3;3个亚铁离子表示为3Fe2+,保持干冰化学性质的最小粒子是二氧化碳分子,表示为CO2.
解答 解:(1)符号前面的数字,表示原子、离子或分子个数;两个汞原子表示为2Hg,故答案为:2Hg;
(2)元素正上方的数字表示元素的化合价,氧化铝中铝元素的化合价表示为$\stackrel{+3}{Al}$2O3;故答案为:$\stackrel{+3}{Al}$2O3;
(3)符号前面的数字,表示原子、离子或分子个数;3个亚铁离子表示为3Fe2+,故答案为:3Fe2+;
(4)保持干冰化学性质的最小粒子是二氧化碳分子,表示为CO2,故答案为:CO2;
点评 本考点考查了化学式和离子符号的书写,元素符号、化学式、化学方程式等化学用语的书写是中考的重要考点之一,要加强练习,理解应用.本考点主要出现在选择题和填空题中.

练习册系列答案
相关题目
12.下列说法正确的有( )
| A. | 在一定量的溶剂里,食盐的饱和溶液比它的不饱和溶液要浓 | |
| B. | 浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液 | |
| C. | 20℃时的硝酸钾饱和溶液,当温度升高到60℃时,其它条件不变,该溶液还是饱和溶液 | |
| D. | 对同一溶质的溶液而言,在一定温度下,饱和溶液比不饱和溶液要浓 |
16.甲、乙两名同学做了碳酸钠溶液与氢氧化钡溶液反应的实验,反应后都进行过滤得到无色滤液,他们对自己得到的无色滤液中溶质的成分进行探究.请你一同参与他们的探究活动
【提出猜想】他们各自所得滤液中溶质的成分有如下几种可能:
A.NaOH B.Na2CO3、Ba(OH)2、NaOH C.Ba(OH)2和NaOH D.Na2CO3和 NaOH
【讨论交流】上述猜想中,肯定不成立的是B(填猜想序号),其理由是Ba(OH)2与Na2CO3不能共存.
【实验探究】甲、乙两同学为了验证各自所得滤液的成分,分别进行了如下实验:
【反思与评价】经过讨论,大家一致认为甲同学的实验结论是正确的,乙同学的实验结论不一定正确,请你帮乙同学设计实验,进一步确定乙同学得到的滤液中溶质的成分.
【提出猜想】他们各自所得滤液中溶质的成分有如下几种可能:
A.NaOH B.Na2CO3、Ba(OH)2、NaOH C.Ba(OH)2和NaOH D.Na2CO3和 NaOH
【讨论交流】上述猜想中,肯定不成立的是B(填猜想序号),其理由是Ba(OH)2与Na2CO3不能共存.
【实验探究】甲、乙两同学为了验证各自所得滤液的成分,分别进行了如下实验:
| 实验操作 | 实验现象 | 实验结论 | |
| 甲同学 | 取少量滤液于试管中,加入足量的碳酸钠溶液 | 产生白色沉淀 | 滤液中溶质的成分与猜想C对应 |
| 乙同学 | 取少量滤液于试管中,加入足量的Na2CO3溶液 | 无明显实验现象 | 滤液中溶质的成分与猜想A对应 |
| 实验操作及实验现象 | 实验结论 |
| 取少量滤液于试管中,滴加稀盐酸,有气泡产生 | 滤液中溶质的成分与猜想D对应 |
13. 化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验.
化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验.
三个小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末.
A组:探究催化剂对化学反应速率的影响
取5mL10%H2O2溶液,三次实验分别加入0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
由此可出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用,某同学对该结论提出疑问.
补充对比实验,操作为取5mL10%H2O2溶液,记录数据.
结果:长时间(大于100s),收集到很少量气体.
更正结论:红砖粉末有(选填“有”、“无”)催化作用,三者中二氧化锰催化效率最高.
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t1.
乙同学:取10mL2.5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t2.
实验结果t1<t2.
结论:浓度越大,反应速率越快.
丙同学:对实验设计提出疑问,并补充实验取10mL5%H2O2溶液,加入0.5gCuO为催化剂,进行实验,记录时间t3..
记录时间t3,且t1<t3<t2.
更正结论为:当催化剂相同时,反应物浓度越大,反应速率越快.
C组:探究温度对化学反应速率的影响.
取10mL5%H2O2溶液和0.5gCuO为催化剂进行实验,两次实验分别将试管置于冰水浴和50℃热水浴记录时间t4、t5,且t4>t5.
结论:当反应物浓度和催化剂相同时,温度越高,反应速率越快.
综上所述:①为了研究某一因素对化学反应速率的影响,必须只允许有一个变量,其他量必须相同.
②探究发现影响化学反应速率的因素有催化剂、反应物浓度、温度.
 化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验.
化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验.三个小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末.
A组:探究催化剂对化学反应速率的影响
取5mL10%H2O2溶液,三次实验分别加入0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
| 试剂 | MnO2 | 红砖粉末 | CuO |
| t/s | 10 | 60 | 20 |
补充对比实验,操作为取5mL10%H2O2溶液,记录数据.
结果:长时间(大于100s),收集到很少量气体.
更正结论:红砖粉末有(选填“有”、“无”)催化作用,三者中二氧化锰催化效率最高.
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t1.
乙同学:取10mL2.5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t2.
实验结果t1<t2.
结论:浓度越大,反应速率越快.
丙同学:对实验设计提出疑问,并补充实验取10mL5%H2O2溶液,加入0.5gCuO为催化剂,进行实验,记录时间t3..
记录时间t3,且t1<t3<t2.
更正结论为:当催化剂相同时,反应物浓度越大,反应速率越快.
C组:探究温度对化学反应速率的影响.
取10mL5%H2O2溶液和0.5gCuO为催化剂进行实验,两次实验分别将试管置于冰水浴和50℃热水浴记录时间t4、t5,且t4>t5.
结论:当反应物浓度和催化剂相同时,温度越高,反应速率越快.
综上所述:①为了研究某一因素对化学反应速率的影响,必须只允许有一个变量,其他量必须相同.
②探究发现影响化学反应速率的因素有催化剂、反应物浓度、温度.
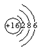 所表示的粒子符号为S,它的最外层电子数为6.
所表示的粒子符号为S,它的最外层电子数为6.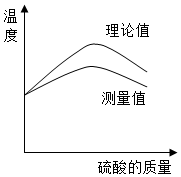 实验小组同学欲利用氢氧化钠溶液与硫酸探究中和反应中的热量变化.请你参与探究实验.
实验小组同学欲利用氢氧化钠溶液与硫酸探究中和反应中的热量变化.请你参与探究实验.