题目内容
12.某化学课外活动小组的同学利用某碱厂的碱渣(含有熟石灰)制取少量烧碱的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.实验操作:取某碱厂的碱渣,加入适量的碳酸钠溶液,充分反应后过滤、蒸发结晶.分析 根据熟石灰能与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,进行分析解答.
解答 解:某碱厂的碱渣(含有熟石灰),熟石灰能与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
实验操作为:取某碱厂的碱渣,加入适量的碳酸钠溶液,充分反应后过滤、蒸发结晶.
故答案为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;取某碱厂的碱渣,加入适量的碳酸钠溶液,充分反应后过滤、蒸发结晶.
点评 本题难度不大,熟练掌握碱的化学性质、化学方程式的书写方法并能灵活运用是正确解答本题的关键.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
2.某小组同学按图所示流程进行实验,用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,请你参与讨论并回答相关问题.
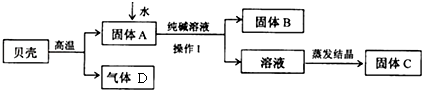
(1)贝壳高温煅烧时,发生反应的化学方程式是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)固体A和还原铁粉是食品包装袋中常用的两种干燥剂.
①可区分两种干燥剂的简单物理方法是用磁铁吸引;
②操作Ⅰ中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是使液体受热均匀,防止液滴外溅;
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH;乙:NaOH和Na2CO3的混合物;丙:NaOH和Ca(OH)2的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.他们的实验操作、现象和结论记录如下表,请参与他们的探究并完成所缺内容.
【反思与评价】根据实验流程,可以判定甲同学设计的方案不严密,理由是:因为碳酸钠、氢氧化钙的水溶液都显碱性,无论碳酸钠过量还是氢氧化钙过量,混有碳酸钠或氢氧化钙的氢氧化钠配成溶液后,都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠.

(1)贝壳高温煅烧时,发生反应的化学方程式是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)固体A和还原铁粉是食品包装袋中常用的两种干燥剂.
①可区分两种干燥剂的简单物理方法是用磁铁吸引;
②操作Ⅰ中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是使液体受热均匀,防止液滴外溅;
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH;乙:NaOH和Na2CO3的混合物;丙:NaOH和Ca(OH)2的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.他们的实验操作、现象和结论记录如下表,请参与他们的探究并完成所缺内容.
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量稀硫酸 | 无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和碳酸钠溶液 | 出现白色沉淀 | 猜想成立 |
20.指出下列溶液中的溶质和溶剂
| 溶液 | 溶质 | 溶剂 |
| 碘酒 | 碘 | 酒精 |
| 稀硫酸 | 硫酸 | 水 |
17.下列标志中属于安全图标的是( )


| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
2.归纳与比较是化学学习的主要方法,有关CO、CO2的不同点比较错误的是( )
| A. | 构成:一个二氧化碳分子比一个一氧化碳分子多一个氧原子 | |
| B. | 性质:CO2能溶于水,但和水不发生化学反应;CO难溶于水,但能燃烧 | |
| C. | 用途:CO2可用于光合作用、灭火;CO可作气体燃料,还可用于冶炼金属 | |
| D. | 危害:CO2会造成温室效应,CO易与血液中的血红蛋白结合引起中毒 |
 某学习小组用如右图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如右图所示装置测定锌铜合金中锌、铜的质量分数. 小明用六块A~F分别对应铁、二氧化碳、硫酸、氢氧化钙、碳酸钠、氯化钡的积木,按照物质能反应积木就叠放在一起,不反应积木间就不接触的原则,搭成如图所示形状.已知E的物质类别与其他5种不同,B与C反应可以生成F,请完成下列问题:
小明用六块A~F分别对应铁、二氧化碳、硫酸、氢氧化钙、碳酸钠、氯化钡的积木,按照物质能反应积木就叠放在一起,不反应积木间就不接触的原则,搭成如图所示形状.已知E的物质类别与其他5种不同,B与C反应可以生成F,请完成下列问题: