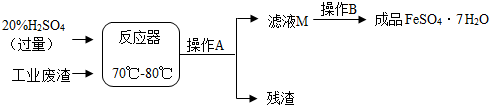
题目内容
1.请运用“守恒”的思想回答下列问题.(1)要配制18%的稀盐酸200g,需要36%的浓盐酸的质量为100g;
(2)将30g氯酸钾跟6g二氧化锰混合后充分加热,冷却后称得剩余固体的质量为26.4g,则生成氧气的质量为9.6g.
分析 (1)根据溶液稀释前后溶质的质量不变,结合题意进行分析解答.
(2)根据质量守恒定律,参加反应的各物质的质量之和等于生成的各物质的质量之和,结合题意进行分析解答.
解答 解:(1)设需要36%的浓盐酸的质量为x,根据溶液稀释前后溶质的质量不变,
则200g×18%=x×36% x=100g.
(2)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,30g氯酸钾跟6g二氧化锰混合后充分加热,冷却后称得剩余固体的质量为26.4g,由质量守恒定律,则生成氧气的质量为30g+6g-26.4g=9.6g.
故答案为:(1)100;(2)9.6.
点评 本题难度不大,掌握溶液稀释前后溶质的质量不变、质量守恒定律并能灵活运用是正确解答本题的关键.

练习册系列答案
相关题目
13.某研究小组探究影响过氧化氢分解速率的因素进行了如下实验.记录了各实验的数据如表:
实验一
(1)通过实验①和②对比可知,化学反应速率与反应物浓度有关;从实验③和④对比可知,化学反应速率与温度的关系是温度越高,化学反应速率越快;
(2)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量不变(选填“减小”或“不变”或“增大”).
资料信息:聪敏同学在网上查阅资料得知:Cu2+、Fe3+对H2O2分解也具有催化作用.
实验二
为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(3)定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
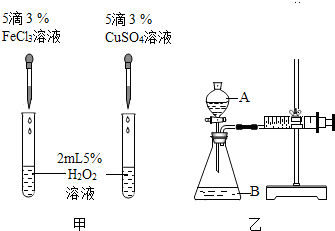
(4)定量分析:如图乙所示进行实验,在装药品前应该检查装置的气密性,具体做法是:将注射器活塞向外拉出一段,松开手一会儿后,若活塞又回到原位,证明装置气密性良好,若实验时均以生成30mL气体为准,其他可能影响实验的因素均已忽略,实验中需要测量的数据是收集30mL气体所需要的时间.
(5)写出图甲任一反应的化学方程式:2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑.
实验一
| 实验序号 | 过氧化氢溶液浓度、% | 过氧化氢溶液体积/ml | 温度/C | 二氧化锰的用量/g | 收集氧气的体积/ml | 反应所需的时间/s |
| 1 | 5 | 1 | 20 | 0.1 | 4 | 16.74 |
| 2 | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| 3 | 30 | 5 | 35 | 2 | 49.21 | |
| 4 | 30 | 5 | 55 | 2 | 10.76 |
(2)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量不变(选填“减小”或“不变”或“增大”).
资料信息:聪敏同学在网上查阅资料得知:Cu2+、Fe3+对H2O2分解也具有催化作用.
实验二
为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(3)定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.

(4)定量分析:如图乙所示进行实验,在装药品前应该检查装置的气密性,具体做法是:将注射器活塞向外拉出一段,松开手一会儿后,若活塞又回到原位,证明装置气密性良好,若实验时均以生成30mL气体为准,其他可能影响实验的因素均已忽略,实验中需要测量的数据是收集30mL气体所需要的时间.
(5)写出图甲任一反应的化学方程式:2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑.
11.煤、和天然气并称为三大化石燃料,煤燃烧会释放出SO2等污染物,这些气体在空气中反应后的生成物溶于雨水,形成酸雨,酸雨对下列物品无损害的是( )
| A. | 大理石塑像 | B. | 铝制门窗 | C. | 玻璃 | D. | 花草树木 |