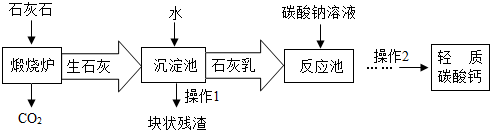
题目内容
2.归纳与比较是化学学习的主要方法,有关CO、CO2的不同点比较错误的是( )| A. | 构成:一个二氧化碳分子比一个一氧化碳分子多一个氧原子 | |
| B. | 性质:CO2能溶于水,但和水不发生化学反应;CO难溶于水,但能燃烧 | |
| C. | 用途:CO2可用于光合作用、灭火;CO可作气体燃料,还可用于冶炼金属 | |
| D. | 危害:CO2会造成温室效应,CO易与血液中的血红蛋白结合引起中毒 |
分析 因为CO2与CO的分子构成不同,所以二者具有不同的性质,根据其不同的性质又决定它们有不同的用途以及造成的危害.
解答 解:A、从化学式上看出,1个二氧化碳分子比1个一氧化碳分子多1个氧原子,故此项说法正确;
B、CO2能溶于水,和水发生化学反应;CO难溶于水,但能燃烧,故此项说法错误;
C、CO2与CO的性质决定它们有这些用途,CO2可用于光合作用、灭火、化工产品的原料和气体肥料;CO可用作气体燃料、冶炼金属的还原剂等,故此项说法正确;
D、二氧化碳是温室气体会造成“温室效应”;CO极易与血液中的血红蛋白结合引起煤气中毒,故此项说法正确.
故选:B.
点评 本题阐述了一个重要的规律:物质的构成决定其性质,物质的性质决定其用途,我们可以根据物质的性质来避免其造成的危害.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
13.某研究小组探究影响过氧化氢分解速率的因素进行了如下实验.记录了各实验的数据如表:
实验一
(1)通过实验①和②对比可知,化学反应速率与反应物浓度有关;从实验③和④对比可知,化学反应速率与温度的关系是温度越高,化学反应速率越快;
(2)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量不变(选填“减小”或“不变”或“增大”).
资料信息:聪敏同学在网上查阅资料得知:Cu2+、Fe3+对H2O2分解也具有催化作用.
实验二
为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(3)定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
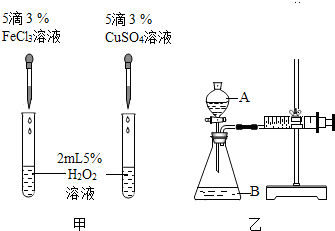
(4)定量分析:如图乙所示进行实验,在装药品前应该检查装置的气密性,具体做法是:将注射器活塞向外拉出一段,松开手一会儿后,若活塞又回到原位,证明装置气密性良好,若实验时均以生成30mL气体为准,其他可能影响实验的因素均已忽略,实验中需要测量的数据是收集30mL气体所需要的时间.
(5)写出图甲任一反应的化学方程式:2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑.
实验一
| 实验序号 | 过氧化氢溶液浓度、% | 过氧化氢溶液体积/ml | 温度/C | 二氧化锰的用量/g | 收集氧气的体积/ml | 反应所需的时间/s |
| 1 | 5 | 1 | 20 | 0.1 | 4 | 16.74 |
| 2 | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| 3 | 30 | 5 | 35 | 2 | 49.21 | |
| 4 | 30 | 5 | 55 | 2 | 10.76 |
(2)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量不变(选填“减小”或“不变”或“增大”).
资料信息:聪敏同学在网上查阅资料得知:Cu2+、Fe3+对H2O2分解也具有催化作用.
实验二
为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(3)定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.

(4)定量分析:如图乙所示进行实验,在装药品前应该检查装置的气密性,具体做法是:将注射器活塞向外拉出一段,松开手一会儿后,若活塞又回到原位,证明装置气密性良好,若实验时均以生成30mL气体为准,其他可能影响实验的因素均已忽略,实验中需要测量的数据是收集30mL气体所需要的时间.
(5)写出图甲任一反应的化学方程式:2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑.
17.为了确定铁、铜、银三种金属的活动性顺序,下列那组物质可达到目的( )
| A. | 铁 稀硫酸 银 | B. | 铁 硫酸亚铁溶液 铜 | ||
| C. | 铁 硝酸铜溶液 银 | D. | 铜 稀盐酸 银 |
14.如表列出了氯化铵在不同温度下的溶解度.(如表数据已近似取整)
(1)氯化铵溶液中的溶质是氯化铵.
(2)由如表可推出氯化铵溶解度的变化规律是氯化铵的溶解度随温度的升高而增大.
(3)在20℃时,向100g水中加入60g氯化铵,若将固体完全溶解,可采用的方法是升高温度或增加溶剂.在60℃时,该饱和0溶液中溶质与溶液的质量比为55:155.
(4)将60℃饱和的氯化铵溶液降温至20℃,没有发生变化的是①③④(填序号).
①水的质量
②氯化铵溶质的质量分数
③60℃时氯化铵的溶解度
④氯元素在氯化铵中的质量分数⑤溶液的质量.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g | 29 | 33 | 37 | 41 | 46 | 50 | 55 | 60 | 66 |
(2)由如表可推出氯化铵溶解度的变化规律是氯化铵的溶解度随温度的升高而增大.
(3)在20℃时,向100g水中加入60g氯化铵,若将固体完全溶解,可采用的方法是升高温度或增加溶剂.在60℃时,该饱和0溶液中溶质与溶液的质量比为55:155.
(4)将60℃饱和的氯化铵溶液降温至20℃,没有发生变化的是①③④(填序号).
①水的质量
②氯化铵溶质的质量分数
③60℃时氯化铵的溶解度
④氯元素在氯化铵中的质量分数⑤溶液的质量.
11.煤、和天然气并称为三大化石燃料,煤燃烧会释放出SO2等污染物,这些气体在空气中反应后的生成物溶于雨水,形成酸雨,酸雨对下列物品无损害的是( )
| A. | 大理石塑像 | B. | 铝制门窗 | C. | 玻璃 | D. | 花草树木 |
12.下列变化属于化学变化的是( )
| A. | 蔗糖溶于水 | B. | 食物发霉 | C. | 酒精挥发 | D. | 西瓜榨汁 |