题目内容
13.人类应合理利用和开发金属资源.金属材料在工农业生产、日常生活中有着广泛应用.(1)铝是地壳中含量最高的金属(填“金属”或“非金属”)元素,铝制品具有很好的抗腐蚀性能,其原因是铝和空气中的氧气反应会生成致密的氧化铝薄膜,阻碍铝的进一步反应.
(2)黄铜是铜锌合金,其硬度比纯铜大(填“大”或“小”),抗腐蚀性能更强(填“弱”或“强”).
(3)将一定质量的锌粒投入含有Cu(NO3)2和Fe(NO3)2的混合溶液中,充分反应后过滤,若滤液中只含一种溶质,则滤渣中一定含有Cu和Fe,发生反应的化学方程式Zn+Cu(NO3)2═Cu+Zn(NO3)2(任写一个即可).
(4)下列有关金属的说法,不正确的是BD
A.地球上的金属资源除Au、Ag等有单质形式存在外,其余都以化合物的形式存在
B.金属锌、铁、铜都能与稀硫酸反应产生氢气
C.防止金属的锈蚀,有利于保护金属资源
D.地球上的金属资源取之不尽.
分析 (1)根据铝是地壳中含量最高的金属,铝和空气中的氧气反应会生成致密的氧化铝薄膜进行分析;
(2)根据合金的性能比组成其纯金属的性能优良进行分析;
(3)根据锌的金属活动性比铁、铜强,充分反应后过滤,若滤液中只含一种溶质,所以硝酸铜、硝酸亚铁完全反应,锌和硝酸铜反应生成硝酸铜和铜进行分析;
(3)A、根据地球上的金属资源除Au、Ag等有单质形式存在外,其余都以化合物的形式存在进行分析;
B、根据金属锌、铁都能与稀硫酸反应产生氢气进行分析;
C、根据防止金属的锈蚀,有利于保护金属资源进行分析;
D、根据地球上的金属资源是有限的进行分析.
解答 解:(1)铝是地壳中含量最高的金属,铝和空气中的氧气反应会生成致密的氧化铝薄膜,阻碍铝的进一步反应;
(2)合金的性能比组成其纯金属的性能优良,所以黄铜是铜锌合金,其硬度比纯铜大,抗腐蚀性能更强;
(3)锌的金属活动性比铁、铜强,充分反应后过滤,若滤液中只含一种溶质,所以硝酸铜、硝酸银完全反应,所以滤渣中一定含有Cu和Fe,锌和硝酸铜反应生成硝酸铜和铜,化学方程式为:Zn+Cu(NO3)2═Cu+Zn(NO3)2;
(3)A、地球上的金属资源除Au、Ag等有单质形式存在外,其余都以化合物的形式存在,故A正确;
B、金属锌、铁都能与稀硫酸反应产生氢气,铜不会与酸反应生成氢气,故B错误;
C、防止金属的锈蚀,有利于保护金属资源,故C正确;
D、地球上的金属资源是有限的,故D错误.
故选:BD.
故答案为:(1)金属,铝在常温下能与氧气反应生成一层致密的氧化膜,阻止铝进一步氧化;
(2)大,强;
(3)Cu和Fe,Zn+Cu(NO3)2═Cu+Zn(NO3)2[或Zn+Fe(NO3)2═Fe+Zn(NO3)2];
(4)BD.
点评 本题主要考查了金属的性质和金属活动性顺序的应用,难度不大,注意加强识记.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式:H2SO4+2NaOH═Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下,请你补上猜想四.
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH 猜想四:有Na2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是三,理由是稀硫酸和氢氧化钠不能共存.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有氢氧化钠.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、AgNO3溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  | 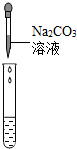 | 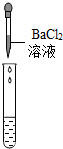 |
| 实验现象 | 试纸变色,对比比色卡,pH=1 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是把pH试纸浸入溶液中.
(2)实验方案中也有一个错误的,错误的原因是硫酸钠也能够和氯化钡反应生成硫酸钡沉淀.
| A. |  闻气体气味 | B. |  制备和检验氢气的可燃性 | ||
| C. |  稀释浓硫酸 | D. |  测溶液pH |
 在实验探究课上,化学老师给大家的是“贝贝熊暖贴”.它是一种一次性取暖片.它的填充物的主要成分是什么?这个问题引起了同学们的好奇.剪开内包装,倒出其中的粉末,发现呈黑色.老师告诉大家,黑色粉末里含有活性炭、铁粉、氧化铜中的一种或几种.请你一起参与同学们的探究:
在实验探究课上,化学老师给大家的是“贝贝熊暖贴”.它是一种一次性取暖片.它的填充物的主要成分是什么?这个问题引起了同学们的好奇.剪开内包装,倒出其中的粉末,发现呈黑色.老师告诉大家,黑色粉末里含有活性炭、铁粉、氧化铜中的一种或几种.请你一起参与同学们的探究:
