题目内容
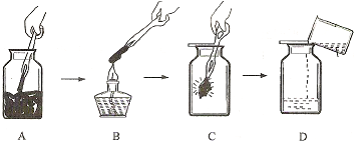
1.有一包白色粉末,可能由CuSO4、Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种组成.为探究其组成,同学们查阅资料得知NaCl、BaCl2溶液呈中性,经过思考设计并进行了以下实验:
请分析实验过程,回答下列问题:
(1)白色粉末中一定不含CuSO4、Na2SO4;可能含有NaOH.
(2)生成白色沉淀的化学方程式为Na2CO3+BaCl2=BaCO3↓+2NaCl.
(3)为最终确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究.
【提出问题】无色滤液中呈碱性的物质是什么?
【作出猜想】猜想Ⅰ:Na2CO3
猜想Ⅱ:NaOH
猜想Ⅲ:Na2CO3和NaOH
【进行实验】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取无色滤液少许于试管中,滴加BaCl2溶液 | 产生白色沉淀 | 猜想Ⅱ不成立 |
| ②在①反应后的试管中滴加无色酚酞溶液 | 溶液变为红色 | 猜想Ⅲ成立 |
分析 根据硫酸铜在溶液中显蓝色,硫酸钠和氯化钡生成不溶于酸的硫酸钡沉淀,碳酸钠和氯化钡生成溶于酸的碳酸钡沉淀,氢氧化钠、碳酸钠的水溶液显碱性等知识进行分析.
解答 解:硫酸铜在溶液中显蓝色,硫酸钠和氯化钡生成不溶于酸的硫酸钡沉淀,碳酸钠和氯化钡生成溶于酸的碳酸钡沉淀,氢氧化钠、碳酸钠的水溶液显碱性.
(1)白色粉末加水溶解得到无色溶液和白色沉淀,所以粉末中一定不含硫酸铜,白色沉淀加入稀盐酸,全部溶解,所以白色粉末中一定含有氯化钡、碳酸钠,一定不含硫酸钠,可能含有氢氧化钠;
(2)生成白色沉淀的反应是碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,化学方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl;
(3)【作出猜想】猜想Ⅲ是Na2CO3和NaOH;
碳酸钠、氢氧化钠都显碱性,都能使无色酚酞变红色,要检验氢氧化钠需要先将碳酸钠检验并除去,所以
| 实验步骤 | 实验现象 | 实验结论 |
| ①取无色滤液少许于试管中,滴加过量的BaCl2溶液 | 产生白色沉淀 | 猜想Ⅱ不成立 |
| ②在①反应后的试管中滴加无色酚酞溶液 | 溶液变为红色 | 猜想Ⅲ成立 |
故答案为:(1)CuSO4、Na2SO4,NaOH;
(2)Na2CO3+BaCl2=BaCO3↓+2NaCl;
(3)【作出猜想】猜想Ⅲ是Na2CO3和NaOH;
【进行实验】
| 实验步骤 | 实验现象 | 实验结论 |
| ①BaCl2溶液 | ||
| ②无色酚酞溶液 | 溶液变为红色 |
点评 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可.

练习册系列答案
相关题目
12.现有含杂质的硝酸钠溶液,为确定其组成,某同学设计了如下实验:

下列判断正确的是( )

下列判断正确的是( )
| A. | 无色溶液B的溶质是硝酸钙 | |
| B. | 原溶液中的杂质只有氯化钙 | |
| C. | 原溶液中的杂质可能由氯化钙、硝酸钙和氯化钠三种物质组成 | |
| D. | 该实验中涉及的基本反应类型不止一种 |
16. 某化学兴趣小组对一包干燥的红色粉末组成进行探究,同学们根据该红色粉末的来源,判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.
某化学兴趣小组对一包干燥的红色粉末组成进行探究,同学们根据该红色粉末的来源,判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.
Ⅰ.定性探究:
【提出猜想】该红色粉末可能是:①Cu ②Fe2O3 ③Cu和Fe2O3
【查阅资料】Cu在FeCl3溶液中发生反应:2FeCl3+Cu═2FeCl2+CuCl2
【设计实验】(1)小玲取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后观察,发现固体全部溶解,得有色溶液.则猜想①一定不成立.
(2)小伟向小玲得到的有色溶液中插入一根洁净的铁丝,反应充分后,观察到铁丝表面有一层红色物质析出现象,得出猜想③成立.
Ⅱ.定量探究:
【提出问题】该红色粉末中氧化铁的质量分数是多少呢?
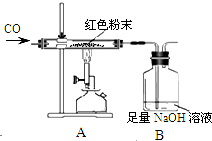
【设计实验】小晨称取该红色粉末5.0g装入硬质玻璃管中,按如图进行实验,开始时缓缓通入CO气体,过一段时间后再加热至高温使其充分反应,待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却,反应前后称量相关物质的总质量(装置内空气中的水蒸气、CO2忽略不计),其数据如表:
【交流讨论】
(1)在装置A中先通CO气体的目的是排尽空气,防止爆炸,A装置中发生反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)为了防止溶液倒吸,本实验最后停止加热前是否需要先断开装置中A和B的连接处?不需要(填“需要”或“不需要”),理由是实验中持续通入一氧化碳气体直到玻璃管内物质冷却.
(3)从环保的角度分析,该装置的缺陷是缺少尾气处理装置.
(4)根据上述表格中的实验数据计算:红色粉末中氧化铁的质量分数为80%.
 某化学兴趣小组对一包干燥的红色粉末组成进行探究,同学们根据该红色粉末的来源,判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.
某化学兴趣小组对一包干燥的红色粉末组成进行探究,同学们根据该红色粉末的来源,判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.Ⅰ.定性探究:
【提出猜想】该红色粉末可能是:①Cu ②Fe2O3 ③Cu和Fe2O3
【查阅资料】Cu在FeCl3溶液中发生反应:2FeCl3+Cu═2FeCl2+CuCl2
【设计实验】(1)小玲取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后观察,发现固体全部溶解,得有色溶液.则猜想①一定不成立.
(2)小伟向小玲得到的有色溶液中插入一根洁净的铁丝,反应充分后,观察到铁丝表面有一层红色物质析出现象,得出猜想③成立.
Ⅱ.定量探究:
【提出问题】该红色粉末中氧化铁的质量分数是多少呢?
【设计实验】小晨称取该红色粉末5.0g装入硬质玻璃管中,按如图进行实验,开始时缓缓通入CO气体,过一段时间后再加热至高温使其充分反应,待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却,反应前后称量相关物质的总质量(装置内空气中的水蒸气、CO2忽略不计),其数据如表:
| 反应前 | 反应后 | |
| Ⅰ组 | 玻璃管和红色粉末的总质量为48.3g | 玻璃管和固体物质的总质量为47.1g |
| Ⅱ组 | 洗气瓶和瓶中所盛物质的总质量为258.6g | 洗气瓶和瓶中所盛物质的总质量为261.9g |
(1)在装置A中先通CO气体的目的是排尽空气,防止爆炸,A装置中发生反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)为了防止溶液倒吸,本实验最后停止加热前是否需要先断开装置中A和B的连接处?不需要(填“需要”或“不需要”),理由是实验中持续通入一氧化碳气体直到玻璃管内物质冷却.
(3)从环保的角度分析,该装置的缺陷是缺少尾气处理装置.
(4)根据上述表格中的实验数据计算:红色粉末中氧化铁的质量分数为80%.
13.元素在自然界里分布并不均匀,从整个的地壳含量的多少分析,最丰富的金属元素是( )
| A. | O | B. | Al | C. | Fe | D. | Si |