题目内容
4.如图是实验室制取和收集二氧化碳可能用到的部分装置.请完成下列问题:
(1)实验室可用A装置制取二氧化碳,仪器a的名称是长颈漏斗,其中反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑.
某同学分析了装置A的特点后,认为选用 M 装置来制取二氧化碳更合理,和装置A比较,你认为M的优点是能随时控制反应的发生和停止;
(2)若用 B 装置来证明CO2的存在,你选择的药品是新配制的澄清石灰水,理由是澄清石灰水和二氧化碳反应有明显现象.气体应从c管(填“b”或“c”)进入装置 B;
(3)收集二氧化碳只能选择装置E,理由是二氧化碳能溶于水,比空气重;
(4)利用 N 装置可以验证二氧化碳的性质并证明二氧化碳能够和氢氧化钠发生反应:则向广口瓶中滴加试剂的顺序是先滴加氢氧化钠溶液,后滴加盐酸,气球的变化情况是气球先胀大后缩小;
(5)随着现代社会经济的迅猛发展以及对能源需求的快速增长,近年来大气中的二氧化碳含量逐年升高,由此造成的温室效应会给环境带来危害,为减缓这种危害的发生,你认为可以采取的必要措施是减少化石燃料的使用,开发新能源,大力植树造林等(回答2条即可).
分析 (1)根据实验室常用仪器的名称和题中所指仪器的作用,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,M装置中的活塞可以控制液体的滴加和停止进行分析;
(2)根据二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,洗气时应该是长进短出进行分析;
(3)根据二氧化碳密度比空气大,溶于水进行分析;
(4)根据氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳进行分析;
(5)根据二氧化碳会产生温室效应,以及减少二氧化碳排放的途径进行分析.
解答 解:(1)通过分析题中所指仪器的作用可知,a是长颈漏斗,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,M装置中的活塞可以控制液体的滴加和停止,所以M的优点是:能随时控制反应的发生和停止;
(2)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,洗气时应该是长进短出,所以选择的药品是新配制的澄清石灰水,理由是澄清石灰水和二氧化碳反应有明显现象,气体应从c管进入装置 B;
(3)二氧化碳密度比空气大,溶于水,所以收集二氧化碳只能选择装置E;
(4)氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,所以向广口瓶中滴加试剂的顺序是先滴加氢氧化钠溶液,后滴加盐酸,气球的变化情况是气球先胀大后缩小;
(5)二氧化碳会产生温室效应,减少二氧化碳排放的途径有:减少化石燃料的使用,开发新能源,大力植树造林等.
故答案为:(1)长颈漏斗,CaCO3+2HCl=CaCl2+H2O+CO2↑,能随时控制反应的发生和停止;
(2)新配制的澄清石灰水,澄清石灰水和二氧化碳反应有明显现象;c;
(3)E,二氧化碳能溶于水,比空气重;
(4)先滴加氢氧化钠溶液,后滴加盐酸;气球先胀大后缩小;
(5)温室效应;减少化石燃料的使用,开发新能源,大力植树造林等.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

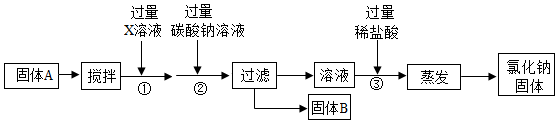
 食盐是生活和工农业生产中最常见的物质之一.晒盐场利用晾晒海水得到粗盐和卤水.
食盐是生活和工农业生产中最常见的物质之一.晒盐场利用晾晒海水得到粗盐和卤水.(1)去除粗盐中难溶性的杂质,主要步骤有:溶解、过滤、蒸发;在过滤操作中,玻璃棒的作用是引流.
(2)在20℃时,向4个盛有200g水的烧杯中,分别加入一定质量的纯净氯化钠固体,并充分搅拌,4组实验数据记录如下
| 实验序号 | ① | ② | ③ | ④ |
| 加入氯化钠的质量/g | 9 | 36 | 81 | 90 |
| 所得溶液的质量/g | 209 | 236 | 272 | 272 |
A.①②所得溶液是不饱和溶液 B.③④所得溶液中,溶液的质量分数相等
C.20℃时,200g水中最多可溶解氯化钠的质量为72g
D.20℃时,将④继续恒温蒸发100g水,过滤,得到质量为36g的固体
(3)卤水的主要成分及其溶解度曲线如图,t1℃时,将3种图中物质的饱和溶液升温到t2℃,3种溶液溶质的质量分数由小到大的顺序是KCl<MgSO4<MgCl2.
| A. | 甲烷 | B. | 木炭 | C. | 蜡烛 | D. | 一氧化碳 |
| A. | 生石灰、氧化钙、CaO | B. | 纯碱、氢氧化钠、NaOH | ||
| C. | 石灰石、氢氧化钙、Ca(OH)2 | D. | 熟石灰、碳酸钙、CaCO3 |
| A. | 将氯化氢和SO2分别通入石蕊试液中,溶液都变为红色,所以它们都是酸类物质 | |
| B. | 离子是带电荷的原子或原子团,所以带电荷的微粒一定是离子 | |
| C. | 酸和碱生成盐和水的反应属于中和反应,故盐酸和氢氧化铜能发生中和反应 | |
| D. | 碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 |
| A. | 完全反应后所得到的氧气比用二氧化锰作催化剂时多 | |
| B. | 高锰酸钾也可作氯酸钾制氧气反应的催化剂 | |
| C. | 反应过程中试管中的固体物质最多可达五种 | |
| D. | 完全反应后试管内的固体物质有三种 |