题目内容
15.如图是实验室常见的制取气体的装置:
(1)写出上图中带标号仪器的名称:①酒精灯,②长颈漏斗.
(2)制取二氧化碳可以用B(填字母)作发生装置,其收集装置通常是E(填字母),理由是二氧化碳密度比空气大、能溶于水,需要的药品是:大理石(或石灰石)和稀盐酸(填名称),请写出相关的实验室制二氧化碳的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)若用上面的装置制取氧气,需要的药品是:过氧化氢和二氧化锰(填名称),请写出相关的实验室制氧气的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,氧气的检验方法是把带火星的木条伸入集气瓶内,若木条复燃,证明是氧气.
分析 (1)据常用仪器回答;
(2)实验室制取二氧化碳用大理石或石灰石和稀盐酸常温混合,属于固液常温型,故选发生装置B,二氧化碳密度比空气大、能溶于水,所以常用向上排空气法收集;
(3)能用制取二氧化碳装置制取氧气的方法是二氧化锰催化过氧化氢,据反应原理书写方程式,检验氧气的方法是将带火星的木条伸入集气瓶内,观察木条是否复燃进行判断.
解答 解:(1)标号仪器分别是酒精灯和长颈漏斗;
(2)实验室制取二氧化碳用大理石或石灰石和稀盐酸常温混合,属于固液常温型,故选发生装置B,二氧化碳密度比空气大、能溶于水,所以常用向上排空气法收集,大理石或石灰石的主要成分碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,反应方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)能用制取二氧化碳装置制取氧气的方法是二氧化锰催化过氧化氢,过氧化氢在二氧化锰催化作用下生成氧气和水,反应方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,检验氧气的方法是将带火星的木条伸入集气瓶内,观察木条是否复燃进行判断;
故答案为:(1)①酒精灯;②长颈漏斗;
(2)B;E;二氧化碳密度比空气大、能溶于水;大理石(或石灰石)和稀盐酸; CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)过氧化氢和二氧化锰;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;把带火星的木条伸入集气瓶内,若木条复燃,证明是氧气.
点评 明确实验室制取气体的装置选取依据、反应原理、检验方法、常用仪器等知识即可顺利解答,发生装置据反应物状态和反应条件选择,收集装置据气体密度和溶解性选择.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
5.“绿色化学”工艺的理想状态是反应物中原子全部转化为欲得到的产物,即原子利用率为100%.下列做法符合“绿色化学”的是( )
| A. | 农民就地焚烧秸秆 | |
| B. | 深埋含镉、汞的废旧电池 | |
| C. | 工业制酒精C2H4+H2O$\frac{\underline{\;催化剂\;}}{\;}$C2H6O | |
| D. | 化工生产中的废气向高空排放 |
3.不锈钢材料中含有的金属铬(Cr)能提高钢的抗氧化性和耐腐蚀性.为了解金属铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,小娟与小涛进行了如下探究活动.
【猜想和假设】根据所学知识,猜想三种金属在金属活动顺序中的相对位置关系:
猜想一:Cr Al Cu 猜想二:Al Cr Cu 猜想三:Al、Cu、Cr
【实验和探究】
(1)小娟的实验:取大小相同的铝、铬、铜三种金属片(用砂纸打磨光亮)
(2)小涛的实验:
小涛只选用了三种药品进行实验,也得出了三种金属在金属活动顺序中的相对位置关系.则他选用的三种药品可能是Al、CrSO4溶液、Cu.
【总结与归纳】由上述实验得出比较金属活动性强弱的方法有:①通过金属与酸反应比较产生气泡的快慢;②通过金属与盐溶液反应比较金属性强弱.
【猜想和假设】根据所学知识,猜想三种金属在金属活动顺序中的相对位置关系:
猜想一:Cr Al Cu 猜想二:Al Cr Cu 猜想三:Al、Cu、Cr
【实验和探究】
(1)小娟的实验:取大小相同的铝、铬、铜三种金属片(用砂纸打磨光亮)
| 实验步骤 | 实验现象 | 解释与结论 |
| 分别取三支试管,向其中入 等质量、等浓度的稀硫酸然 后将铝、铬、铜三种金属分 别插入三支试管中. | 铝片表面产生的气泡较快; 铬片表面产生气泡较缓慢, 溶液变蓝色; 铜片无明显现象. | 猜想二成立. 铬与稀硫酸反应生成蓝色的 硫酸亚铬(CrSO4)溶液,该反应的化学方程式为Cr+H2SO4=CrSO4+H2↑. |
小涛只选用了三种药品进行实验,也得出了三种金属在金属活动顺序中的相对位置关系.则他选用的三种药品可能是Al、CrSO4溶液、Cu.
【总结与归纳】由上述实验得出比较金属活动性强弱的方法有:①通过金属与酸反应比较产生气泡的快慢;②通过金属与盐溶液反应比较金属性强弱.
20.漂白粉的主要成分为次氯酸钙[Ca(ClO)2]和氯化钙,既可用作漂白剂,又可用作消毒剂.漂白粉中有效成分是[Ca(ClO)2],漂白的原理是:Ca(ClO)2在空气中发生反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,易分解生成HCl和一种常见的单质气体.HClO具有漂白性,能使品红等有色物质褪色.
【漂白粉制取的研究】
有人提出可以利用海水(含NaCl)和石灰石为原料制取漂白粉,该方法流程如下:
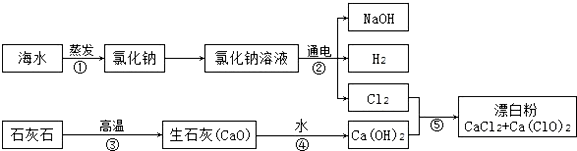
(1)HClO在常温下分解,反应为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH减小(填“增大”或“减小”或“不变”).
(2)⑤中的反应是2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2X,X的化学式为H2O,其中Ca(ClO)2中氯元素的化合价为+1.
(3)实际工业生产中,反应⑤的反应物Ca(OH)2最好用石灰乳,(填“饱和石灰水”或“石灰乳”)并不断搅拌.
【定性研究】
有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验.
【提出问题】长时间放置的漂白粉是否变质?
【猜 想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为CaCl2、Ca(ClO)2、CaCO3;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3.
【实验探究】
【定量研究】
已知漂白粉有效成分能与浓盐酸发生如下反应Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O,某同学通过查阅资料,设计一个最简单的实验,测定漂白粉有效成分的质量分数.
【资料】Cl2能溶于水,但在饱和食盐水中的溶解性非常小.实验条件下Cl2的密度为3.17g/L.氯化氢气体易溶于水.
【实验探究】
(4)甲同学准确称取0.5g漂白粉样品,检查装置气密性后装入图A中,进行实验.实验结束后,量筒内收集到89.6mL食盐水.据此计算,此样品中有效成分的质量分数.(写出计算过程,结果精确到0.1%)
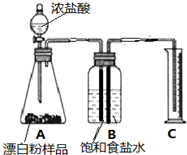
(5)在读取量筒的刻度数时,应注意①视线与凹液面最低点应齐平;②装置内气体应恢复至室温;③B、C两仪器内的液面应齐平.
(6)实验结束后,同学们发现,此装置存在着明显的不足:ABC(填序号)
A没有考虑到盐酸占据的体积对测定结果的影响.
B没有考虑到残留在导管中的液体和导管本身的体积对测定结果的影响.
C没有考虑到氯气中可能混有的二氧化碳气体对测定结果的影响
D没有考虑到氯气中可能混有的氯化氢气体对实验结果的影响.
【漂白粉制取的研究】
有人提出可以利用海水(含NaCl)和石灰石为原料制取漂白粉,该方法流程如下:

(1)HClO在常温下分解,反应为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH减小(填“增大”或“减小”或“不变”).
(2)⑤中的反应是2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2X,X的化学式为H2O,其中Ca(ClO)2中氯元素的化合价为+1.
(3)实际工业生产中,反应⑤的反应物Ca(OH)2最好用石灰乳,(填“饱和石灰水”或“石灰乳”)并不断搅拌.
【定性研究】
有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验.
【提出问题】长时间放置的漂白粉是否变质?
【猜 想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为CaCl2、Ca(ClO)2、CaCO3;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3.
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| 取少量样品于试管中,滴加足量的稀盐酸. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| 在上述反应后的试管中加少量品红溶液. | 红色变浅或消失. |
已知漂白粉有效成分能与浓盐酸发生如下反应Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O,某同学通过查阅资料,设计一个最简单的实验,测定漂白粉有效成分的质量分数.
【资料】Cl2能溶于水,但在饱和食盐水中的溶解性非常小.实验条件下Cl2的密度为3.17g/L.氯化氢气体易溶于水.
【实验探究】
(4)甲同学准确称取0.5g漂白粉样品,检查装置气密性后装入图A中,进行实验.实验结束后,量筒内收集到89.6mL食盐水.据此计算,此样品中有效成分的质量分数.(写出计算过程,结果精确到0.1%)

(5)在读取量筒的刻度数时,应注意①视线与凹液面最低点应齐平;②装置内气体应恢复至室温;③B、C两仪器内的液面应齐平.
(6)实验结束后,同学们发现,此装置存在着明显的不足:ABC(填序号)
A没有考虑到盐酸占据的体积对测定结果的影响.
B没有考虑到残留在导管中的液体和导管本身的体积对测定结果的影响.
C没有考虑到氯气中可能混有的二氧化碳气体对测定结果的影响
D没有考虑到氯气中可能混有的氯化氢气体对实验结果的影响.
7.下列实验现象描述正确的是( )
| A. | 打开盛有浓盐酸的瓶盖,瓶口出现白烟 | |
| B. | 铜丝浸入硝酸银溶液中,溶液由蓝色变无色 | |
| C. | 二氧化碳通入石蕊溶液中,溶液由红色变紫色 | |
| D. | 硝酸银溶液中加入稀盐酸,产生白色沉淀 |


