题目内容
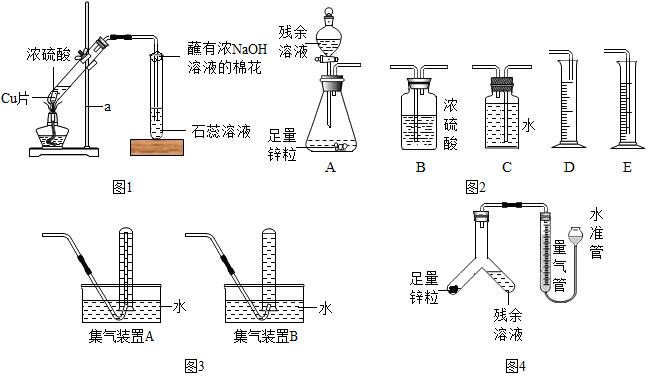
10.某化学兴趣小组利用如图装置探究制取气体的原理、方法及性质.结合装置图,回答下列问题:
(1)写出图中标号仪器的名称:a长颈漏斗 b锥形瓶.
(2)用过氧化氢溶液制取氧气时,可选用的发生装置是B (填字母),可选用E装置收集氧气的原因是氧气不易溶于水,还能选择的收集装置是C,此装置氧气的验满方法用带水星的木条放到集气瓶口,如木条复燃,说明氧气已收集满,写出此反应的文字表达式过氧化氢$\stackrel{二氧化锰}{→}$水+氧气.
(3)若选用高锰酸钾制取氧气,可选用的发生A装置是A( 填字母 ),但有一点不足之处是试管中的导管口没有放一小团棉花,该错误导致的后果高锰酸钾颗粒进入导管.
写出此反应的文字表达式高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气.
(4)实验室常用氯化铵固体与碱石灰固体共热来制取氨气,应选择的发生装置是A(填字母).
已知氨气易溶于水,且密度比空气的小,所以,氨气的收集装置应该选择D(填字母).
分析 (1)根据实验室常用仪器解答;
(2)发生装置的选择要看反应物的状态和反应条件;收集装置的选择要看气体的密度和溶解性;据反应原理写出文字表达式;
(3)根据实验室用高锰酸钾制取氧气的注意事项分析解答;
(4)根据实验室制取氨气的反应物是固体,反应条件是加热,氨气密度比空气小,极易溶于水进行分析.
解答 解:(1)根据实验室常用仪器可知:a长颈漏斗;b锥形瓶;
(2)实验室用过氧化氢溶液和二氧化锰制取氧气,反应不需加热,属于固液常温型,可选用的发生装置是B;可用E装置收集氧气的原因是氧气不易溶于水,还能选择的收集装置是C,此装置氧气的验满方法用带水星的木条放到集气瓶口,如木条复燃,说明氧气已收集满,此反应的文字表达式为:过氧化氢$\stackrel{二氧化锰}{→}$水+氧气;
(3)实验室用高锰酸钾制取氧气可选用的发生装置是A,用A装置来制取氧气时要在试管中的导管口放一小团棉花,来阻挡高锰酸钾颗粒进入导管,此反应的文字表达式为:高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气.
(4)实验室制取氨气的反应物是固体,反应条件是加热,氨气密度比空气小,极易溶于水,所以应该选择的发生装置是A,收集装置是D.
故答案为:(1)a长颈漏斗;b锥形瓶;
(2)B;氧气不易溶于水;C;用带水星的木条放到集气瓶口,如木条复燃,说明氧气已收集满;过氧化氢$\stackrel{二氧化锰}{→}$水+氧气;
(3)A;试管中的导管口没有放一小团棉花;高锰酸钾颗粒进入导管;高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气.
(4)A;D.
点评 本题考查了常见气体发生装置和收集装置的选择,完成此题,可以依据已有的知识进行.要求同学们在完成此类题目时,要熟知反应物的状态和反应的条件以及气体的密度和水溶性,以便做出正确的判断.

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| 时间/s | 0 | 30 | 50 | 90 | 120 | 150 | 180 |
| 质量/g | 0 | 30 | 50 | 60 | 80 | 66 | 66 |
(1)表中有一个测量结果有较大的误差,这一点所对应的时间是120.
(2)计算该200g水垢中所含碳酸钙的质量分数.
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 稀盐酸的累计加入量 | 8.0g | 16.0g | 24.0g | 32.0g | 40.0g |
| 剩余固体的质量 | 9g | 6g | 3g | 2g | 2g |
(2)请你继续计算反应生成物溶液的溶质的质量分数(计算过程和结果均保留一位小数).
| A. | 拉瓦锡 | B. | 门捷列夫 | C. | 阿伏伽德罗 | D. | 道尔顿 |