��Ŀ����
20��Ư�۵���Ҫ�ɷ�Ϊ�������[Ca��ClO��2]���Ȼ��ƣ��ȿ�����Ư�����ֿ�������������Ư������Ч�ɷ���[Ca��ClO��2]��Ư��ԭ���ǣ�Ca��ClO��2�ڿ����з�����ӦCa��ClO��2+CO2+H2O=CaCO3��+2HClO��HClO��һ�����Ա����������ᣬ���ȶ����ֽ�����HCl��һ�ֳ����ĵ������壮HClO����Ư���ԣ���ʹƷ�����ɫ������ɫ����Ư����ȡ���о���
��������������ú�ˮ����NaCl����ʯ��ʯΪԭ����ȡƯ�ۣ��÷����������£�
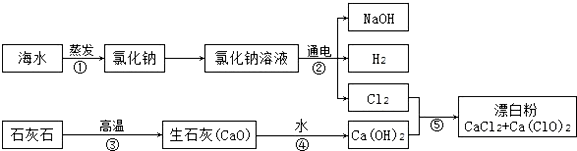
��1��HClO�ڳ����·ֽ⣬��ӦΪ2HClO=2HCl+O2����ijƿHClO��Һ����һ��ʱ�����Һ��pH��С�������С�����䡱����
��2�����еķ�Ӧ��2Ca��OH��2+2Cl2�TCaCl2+Ca��ClO��2+2X��X�Ļ�ѧʽΪH2O������Ca��ClO��2����Ԫ�صĻ��ϼ�Ϊ+1��
��3��ʵ�ʹ�ҵ�����У���Ӧ�ݵķ�Ӧ��Ca��OH��2�����ʯ���飬�������ʯ��ˮ����ʯ���顱�������Ͻ��裮
���������
��һ����ʱ����õ�Ư�ۣ���֪����Ư���Ƿ���ʣ�ijͬѧ���������̽��ʵ�飮
��������⡿��ʱ����õ�Ư���Ƿ���ʣ�
���� �롿
����1����Ư��δ���ʣ�����ɷ�ΪCaCl2��Ca��ClO��2��
����2����Ư�۲��ֱ��ʣ�����ɷ�ΪCaCl2��Ca��ClO��2��CaCO3��
����3����Ư��ȫ�����ʣ�����ɷ�ΪCaCl2��CaCO3��
��ʵ��̽����
| ʵ����� | ʵ������ | ʵ����� |
| ȡ������Ʒ���Թ��У��μ�������ϡ���ᣮ | ���������������ʹʯ��ˮ����ǣ� | ����2���� |
| ��������Ӧ����Թ��м�����Ʒ����Һ�� | ��ɫ��dz����ʧ�� |
��֪Ư����Ч�ɷ�����Ũ���ᷢ�����·�ӦCa��ClO��2+4HCl�TCaCl2+2Cl2��+2H2O��ijͬѧͨ���������ϣ����һ�����ʵ�飬�ⶨƯ����Ч�ɷֵ�����������
�����ϡ�Cl2������ˮ�����ڱ���ʳ��ˮ�е��ܽ��Էdz�С��ʵ��������Cl2���ܶ�Ϊ3.17g/L���Ȼ�������������ˮ��
��ʵ��̽����
��4����ͬѧȷ��ȡ0.5gƯ����Ʒ�����װ�������Ժ�װ��ͼA�У�����ʵ�飮ʵ���������Ͳ���ռ���89.6mLʳ��ˮ���ݴ˼��㣬����Ʒ����Ч�ɷֵ�������������д��������̣������ȷ��0.1%��
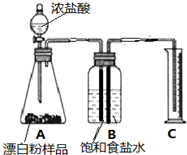
��5���ڶ�ȡ��Ͳ�Ŀ̶���ʱ��Ӧע��������밼Һ����͵�Ӧ��ƽ����װ��������Ӧ�ָ������£���B��C�������ڵ�Һ��Ӧ��ƽ��
��6��ʵ�������ͬѧ�Ƿ��֣���װ�ô��������ԵIJ��㣺ABC������ţ�
Aû�п��ǵ�����ռ�ݵ�����Բⶨ�����Ӱ�죮
Bû�п��ǵ������ڵ����е�Һ��͵��ܱ���������Բⶨ�����Ӱ�죮
Cû�п��ǵ������п��ܻ��еĶ�����̼����Բⶨ�����Ӱ��
Dû�п��ǵ������п��ܻ��е��Ȼ��������ʵ������Ӱ�죮
���� ��Ư����ȡ���о���
������Һ����������ж�pH��С��
��ѧ��Ӧǰ��Ԫ�ص�����䣬ԭ�ӵ����ࡢ�ܸ������䣻
��������Ԫ�صĻ��ϼ۴�����Ϊ�㣻
�������Ƶ��ܽ�Ⱥ�С��
��ʵ��̽����
̼����ܹ�ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��
��������ʹƷ����Һ��ɫ��
��ʵ��̽����
����ռ�ݵ�����������ڵ����е�Һ��͵��ܱ���������������п��ܻ��еĶ�����̼����ȶԲⶨ��������Ӱ�죮
��� �⣺��Ư����ȡ���о���
��1������HClO�ڳ����·ֽ⣬��Ӧ����ʽ��֪��2HClO=2HCl+O2����HClO��Һ����һ��ʱ�����Һ��������ǿ����Һ��pH��С��
��2����2Ca��OH��2+2Cl2�TCaCl2+Ca��ClO��2+2X�������غ㶨�ɿ�֪��ÿ��X�к���2����ԭ�Ӻ�1����ԭ�ӣ�X��ˮ��ˮ�Ļ�ѧʽ���Ա�ʾΪH2O��
����Ԫ�صĻ��ϼ�Ϊx��
������������+2��+x��2+��-2����2=0��
x=+1��
��3��ʵ�ʹ�ҵ�����У���Ϊʯ�����б�ʯ��ˮ�к��и�����������ƣ����Է�Ӧ�ݵķ�Ӧ��Ca��OH��2�����ʯ���鲢���Ͻ��裮
��ʵ��̽����
ʵ�������ʵ�������ʵ��������±���ʾ��
| ʵ����� | ʵ������ | ʵ����� |
| ��ȡ������Ʒ���Թ��У��μ�������ϡ���ᣮ | ���������������ʹʯ��ˮ����ǣ� | ����2���� |
| ����������Ӧ����Թ��м�����Ʒ����Һ�� | ��ɫ��dz����ʧ�� |
��4����Ca��ClO��2������Ϊy��
��Ӧ��������������Ϊ��3.17g/L��0.0896L=0.284g��
Ca��ClO��2+4HCl�TCaCl2+2Cl2��+2H2O��
143 142
y 0.284g
$\frac{143}{y}=\frac{142}{0.284g}$��
y=0.286g��
����Ʒ����Ч�ɷֵ���������Ϊ��$\frac{0.286g}{0.5g}$��100%=57.2%��
��5���ڶ�ȡ��Ͳ�Ŀ̶���ʱ��Ӧע��������밼Һ����͵�Ӧ��ƽ����װ��������Ӧ�ָ������£���B��C�������ڵ�Һ��Ӧ��ƽ��
��6����װ�ô��������ԵIJ����ǣ�û�п��ǵ�����ռ�ݵ�����Բⶨ�����Ӱ�죬û�п��ǵ������ڵ����е�Һ��͵��ܱ���������Բⶨ�����Ӱ�죬û�п��ǵ������п��ܻ��еĶ�����̼����Բⶨ�����Ӱ�죮
�ʴ�Ϊ����1����С����2��H2O��+1����3��ʯ���飮
��4��57.2%����5��B��C�������ڵ�Һ��Ӧ��ƽ����6��ABC��
���� �������ʵ�飬��ѧ�ؽ���ʵ�顢����ʵ�飬�ǵó���ȷʵ����۵�ǰ�ᣬ���Ҫѧ�����ʵ�顢����ʵ�顢����ʵ�飬Ϊѧ�û�ѧ֪ʶ�춨������

 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�| A�� | һ�������к���9��ˮ���� | |
| B�� | ��ԭ������������ȫȼ������CO2��H2O | |
| C�� | �������������Ԫ�غ������ | |
| D�� | �����⡢��Ԫ�ص�������Ϊ2��1 |
| A�� | Fe3O4��Fe2O3��FeO��FeS2 | B�� | FeO��Fe2O3��Fe3O4��FeS2 | ||
| C�� | FeO��Fe3O4��Fe2O3��FeS2 | D�� | Fe2O3��Fe3O4��FeO��FeS2 |
��������⡿��1������������ٻƽ𣿣�2������ȷ���ٵĽ�����ԣ�
���������ϡ���1���ٻƽ�ͨ���ǻ�ͭ��Cu-Zu�Ͻ� ��2���٣�Pd��������ɫ���н�������������Ʒ
��ʵ��ҩƷ �١�����Pt����ϡ���ᡢ��������Һ���Ȼ��٣�PdCl2����Һ
��ʵ��̽������1������ƽ���Ʒ����٣�ȡ�ƽ���Ʒ���Թ��У��μ�ϡ����۲�ƽ���Ʒ���������ݲ������������������������ƣ���˵������ƷΪ�٣���桱�١����ƽ�
��2��̽���ٵĽ�����ԣ���������飬ͬѧ�Dz²��ٵĻ�Կ��������Ͳ����������������������ҩƷ��������ʵ�飺
| ʵ�鲽�� | ʵ������ | ʵ����� |
| ���ٽ�����������Һ�� | ���������� | �ٵĻ�Ա����� |
| �Ѳ������Ȼ�����Һ�� | ���������� | �ٵĻ�ԱȲ�ǿ |
����Һ��������1��ת���ɳ�����С��ͬѧ����Һ�嵹���Һȱ���У����ְ�ɫ������д������������Ļ�ѧ����ʽ��ZnCl2+2AgNO3=2AgCl��+Zn��NO3��2��д��һ�����ɣ���
��2��ͨ����ѧ�����ķ�����һ�����ս����٣�

| 20���϶�һЩ���ʵ��ܽ�ȣ�g�� | |||
| �Ȼ��� | �Ȼ�� | ̼������ | ̼����� |
| 35.9 | 37.2 | 9.6 | 21.7 |
��NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3�� ��2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+CO2��+H2O ��ش�
��1����Ӧ�ٵĻ�ѧ����ʽCaCO3$\frac{\underline{\;����\;}}{\;}$CaO+CO2����
��2����������a����������ĸҺ�ǵ�HCO3�ı��ͣ�����͡������͡�����Һ��д��ĸҺ���������ʵĻ�ѧʽ��NaHCO3��NH4Cl��NaCl
��3���ó�ĸҺ���Ȼ�泥�д���ƣ����������еĵ��ʣ���Ҳ����Ca��OH��2�ڼ���ʱ������Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ��Ca��OH��2+2NH4Cl=CaCl2+H2O+CO2����
��4���������п���ѭ�����õ�������CO2��д��ѧʽ��

