题目内容
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
________________________________________________________________________。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表
示)________________________________________________________________________
________________________________________________________________________。
(3)C为0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液中相比较______(填溶质的化学式)溶液中NH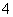 的浓度更大,其原因是
的浓度更大,其原因是
________________________________________________________________________
________________________________________________________________________。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)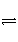
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25 ℃时,AgCl的Ksp=1.8×10-10mol2·L-2。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1 MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为______(填序号),此时溶液②中Cl-物质的量浓度为________。
答案 (1)c(NH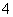 )>c(SO
)>c(SO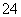 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
(2)HCO
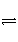
 H++CO
H++CO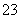 ;HCO
;HCO +H2O
+H2O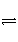
 H2CO3+OH-;H2O
H2CO3+OH-;H2O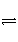
 H+OH-
H+OH-
(3)(NH4)2Fe(SO4)2 Fe2+消解显酸性,对NH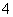 的消解有抑制作用
的消解有抑制作用
(4)②①③ 6×10-10 mol·L-1
解析 (1)NH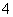 消解显酸性且水解程度小,所以有:
消解显酸性且水解程度小,所以有:
c(NH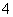 )>c(SO
)>c(SO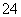 )>c(H+)>c(OH-)。
)>c(H+)>c(OH-)。
(2)NaHCO3溶液中存在三个平衡体系:
①HCO 的电离平衡:HCO
的电离平衡:HCO
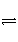
 H++CO
H++CO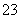 ;②HCO
;②HCO 的消解平衡:HCO
的消解平衡:HCO +H2O
+H2O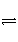
 H2CO3+OH-;③H2O的电离平衡:H2O
H2CO3+OH-;③H2O的电离平衡:H2O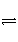
 H++OH-;
H++OH-;
(3)(NH4)2Fe(SO4)2溶液中,Fe2+消解产生的H+对NH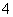 水解起抑制作用,NH
水解起抑制作用,NH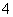 水解程度小,与同浓度的(NH4)2SO4溶液相比,前者NH
水解程度小,与同浓度的(NH4)2SO4溶液相比,前者NH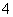 的浓度更大。
的浓度更大。
(4)①与③相比,③溶液中的Cl-使AgCl的溶解平衡逆向移动,c(Ag+)最小,②中溶液中的Ag+虽然使AgCl的溶解平衡逆向移动,但溶液中Ag+的浓度要比①、③中Ag+的浓度大的多。所以②中Ag+浓度最大。②中c(Cl-)=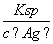 =
=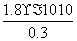 mol·L-1=6×10-10 mol·L-1。
mol·L-1=6×10-10 mol·L-1。

下表为某品牌燕麦片标签中的一部分。
| 营养成分 | 蛋白质(g) | 糖类(g) | 脂肪(g) | 钙(mg) | 铁(mg) | 钠(mg) | 锌(mg) | 维生素C(mg) |
| 每100g含 | 7.4 | 7.8 | 7.9 | 206 | 19.2 | 37.8 | 10.1 | 18 |
(1)上表出现了六大类营养素中的  类。
类。
(2)若人体缺铁会引起 。
(3)人体健康离不开钙元素。下列有关钙元素的叙述中,不正确的是(填序号) 。
A、人体中钙元素大部分存在于骨 骼和牙齿中
骼和牙齿中
B、幼儿及青少年缺钙会得佝偻病和发育不良
C、老年人缺钙会发生骨质疏松,容易骨折
D、成年人比幼儿和青少年需要摄入更多的钙
(4)假设每克蛋白质完全氧化放出热量约为18 kJ,则每100 g燕麦片中蛋白质完全氧化所放出的热量约为 kJ。
 O2(g)===CO(g) ΔH1=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH1=-110.5 kJ·mol-1