题目内容
将0.2 mol·L-1 HA溶液与0.2 mol·L-1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则(用“>”、“<”或“=”填写下列空白):
(1)混合溶液中c(HA)________c(A-);
(2)混合溶液中c(HA)+c(A-)________0.1 mol·L-1;
(3)混合溶液中由水电离出的c(OH-)______0.2 mol·L-1 HA溶液中由水电离出的c(H+);
(4)25℃时,如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度________NaA的水解程度。
答案 (1)< (2)= (3)> (4)>
解析 (1)混合后恰生成NaA,由于c(Na+)>c(A-),根据电荷守恒得c(H+)<c(OH-),溶液呈碱性,A-水解程度弱,c(HA)<c(A-)。
(2)由物料守恒,c(HA)+c(A-)=c(Na+)=0.1 mol·L-1。
(3)混合溶液中促进了水的电离,故前者大。
(4)HA剩余溶液呈酸性,故前者程度大。

练习册系列答案
相关题目
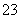 )+c(HCO
)+c(HCO )+c(H2CO3)
)+c(H2CO3)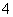 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)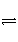
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)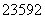 U和
U和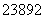 U是铀的两种主要的同位素。
U是铀的两种主要的同位素。