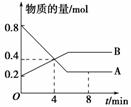
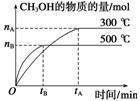
题目内容
已知反应:①101 kPa时,C(s)+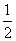 O2(g)===CO(g) ΔH1=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH1=-110.5 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1
下列结论正确的是( )
A.若碳的燃烧热用ΔH3来表示,则ΔH3<ΔH1
B.若碳的燃烧热用ΔH3来表示,则ΔH3>ΔH1
C.浓硫酸与稀NaOH溶液反应的中和热为57.3 kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ
答案 A
解析 反应①中碳未完全燃烧,其放出的热量小于碳完全燃烧时放出的热量,放出热量越多,ΔH越小,即ΔH3<ΔH1,A项正确;浓H2SO4稀释要放热,故C项反应的反应热比57.3 kJ·mol-1大;D项中醋酸为弱酸,电离吸热,故D项反应生成1 mol水放出热量小于57.3 kJ。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
 ( )
( ) 不能随意开采
不能随意开采 的浓度更大,其原因是
的浓度更大,其原因是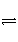
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
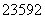 U和
U和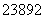 U是铀的两种主要的同位素。
U是铀的两种主要的同位素。