题目内容
5.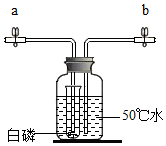 用如图所示装置研究白磷和氧气的反应,装置中试管内液面与试管外相平.
用如图所示装置研究白磷和氧气的反应,装置中试管内液面与试管外相平.(1)白磷在氧气燃烧的化学方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(2)打开a、b两侧的止水夹,从b处通入氧气,可观察到试管内液面下降,白磷燃烧,产生大量白烟.
(3)白磷开始燃烧后,停止通入氧气,关闭a侧止水夹,观察到以下现象:开始时试管外的液面下降;白磷熄灭后,会看到上升.开始时试管外液面下降的原因是白磷燃烧放出了大量的热.
分析 只有熟悉用白磷测定空气组成的实验原理、操作、现象、结论和注意事项,才能正确解答本题.
解答 解:(1)磷与氧气在点燃的条件下反应生成五氧化二磷,反应化学方程式为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(2)打开a、b两侧的止水夹,从b处通入氧气,瓶内压强增大,可观察到试管内液面下降,白磷燃烧,产生大量白烟.
(3)白磷开始燃烧后,停止通入氧气,关闭a侧止水夹,观察到以下现象:开始时试管外的液面下降;白磷熄灭后,会看到上升.开始时试管外液面下降的原因是白磷燃烧放出了大量的热,瓶内压强增大.
故答为:(1)4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.(2)下降.(3)上升:白磷燃烧放出了大量的热,瓶内压强增大.
点评 本题主要考查用白磷测定空气组成的实验原理、操作、现象、结论和注意事项,难度稍大,需学生结合课本知识仔细推敲.

练习册系列答案
相关题目
15.有一种石灰石样品,某中含有的杂质是二氧化硅(它是一种不溶于水,也不与盐酸反应,耐高温的固体物质),某同学想测定该样品中CaCO3的质量分数,他取用2.0g这种石灰石样品,把20g稀盐酸分四次加入,充分反应后剩余固体的质量见表所示:
(1)2.0g石灰石样品中的杂质质量是0.40;
(2)石灰石样品中CaCO3的质量分数是多少?
(3)100kg这种纯度的石灰石充分煅烧后,可得到固体多少克?
| 稀盐酸的质量 | 剩余固体的质量 |
| 第1次加入5g | 1.315g |
| 第2次加入5g | 0.63g |
| 第3次加入5g | 0.40g |
| 第4次加入5g | 0.40g |
(2)石灰石样品中CaCO3的质量分数是多少?
(3)100kg这种纯度的石灰石充分煅烧后,可得到固体多少克?
16.自然界中存在氧循环和碳循环,其中能将二氧化碳转化为氧气的是( )
| A. | 燃料燃烧 | B. | 光合作用 | C. | 溶洞形成 | D. | 动物呼吸 |
17.在温室大棚中种植蔬菜,经常向棚内施放二氧化碳,其目的是( )
| A. | 产生温室效应,提高棚内的温度 | |
| B. | 使害虫窒息死亡,防止植物病虫害 | |
| C. | 促进植物的光合作用,提高蔬菜的产量和品质 | |
| D. | 避免棚内发生火灾 |
14.在家庭小实验中,不能达到预期目的是( )
| A. | 品尝--鉴别白糖和食盐 | B. | 观察--鉴别精白面粉和淀粉 | ||
| C. | 闻气味--鉴别白酒和白醋 | D. | 点燃--鉴别氧气和天然气 |
15.下列化学方程式中属于置换反应且书写正确的是( )
| A. | 氢气还原氧化铜 H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O | |
| B. | 一氧化碳还原氧化铜 CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | |
| C. | 生石灰与水的反应 CaO+H2O═Ca(OH)2 | |
| D. | 盐酸与碳酸钠反应 2HCl+Na2CO3═2NaCl+CO2+H2O |
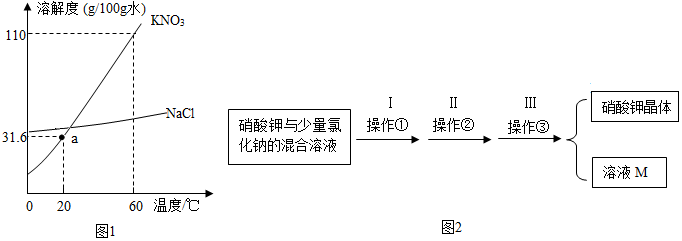
 地质博物馆中有许多矿石标本,其中的3种矿石如图所示:
地质博物馆中有许多矿石标本,其中的3种矿石如图所示: 蜡烛充分燃烧生成CO2和H2O,消耗O2和生成CO2的体积比是3:2.如图所示,用玻璃杯迅速扣住燃烧的蜡烛,并使杯口始终浸没在水中.蜡烛熄灭后,看到的现象是玻璃杯内液面上升.
蜡烛充分燃烧生成CO2和H2O,消耗O2和生成CO2的体积比是3:2.如图所示,用玻璃杯迅速扣住燃烧的蜡烛,并使杯口始终浸没在水中.蜡烛熄灭后,看到的现象是玻璃杯内液面上升.