题目内容
15.有一种石灰石样品,某中含有的杂质是二氧化硅(它是一种不溶于水,也不与盐酸反应,耐高温的固体物质),某同学想测定该样品中CaCO3的质量分数,他取用2.0g这种石灰石样品,把20g稀盐酸分四次加入,充分反应后剩余固体的质量见表所示:| 稀盐酸的质量 | 剩余固体的质量 |
| 第1次加入5g | 1.315g |
| 第2次加入5g | 0.63g |
| 第3次加入5g | 0.40g |
| 第4次加入5g | 0.40g |
(2)石灰石样品中CaCO3的质量分数是多少?
(3)100kg这种纯度的石灰石充分煅烧后,可得到固体多少克?
分析 (1)由于样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水,因此由表中每次加入5g稀盐酸固体减少的质量关系可判断:每加入5g稀盐酸固体应减少0.685g;据此规律,由第四次加入盐酸后固体质量的减少值小于0.685g可判断此次反应后碳酸钙已完全反应;
(2)利用样品杂质的质量,由此求出石灰石样品中碳酸钙的质量分数;
(3)根据碳酸钙高温下分解反应的化学方程式,确定分解的碳酸钙与放出二氧化碳的质量关系,可由石灰石中碳酸钙的质量计算求出能得到氧化钙的质量,最后用氧化钙的质量加上100kg这种纯度的石灰石中杂质的质量即可.
解答 解:(1)根据表中的实验数据可得,每加入5g稀盐酸,固体质量减少0.685g,第三次加入稀盐酸后,固体减少的质量=0.63g-0.40g=0.23g,小于0.685g,即此时碳酸钙已完全反应;所以剩余的0.40g固体即为杂质的质量;故答案为:0.40g;
(2)石灰石样品中碳酸钙的质量分数=$\frac{2g-0.40}{2g}×100%$=80%;
(3)设能得到氧化钙的质量为x
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 56
100kg×80% x
$\frac{100}{56}=\frac{100kg×80%}{x}$
解得:x=44.8g
得到固体的质量为:44.8g+$\frac{0.4g×100kg}{2g}$=64.8kg
答:(2)石灰石样品中CaCO3的质量分数是80%;
(2)100kg这种纯度的石灰石充分煅烧后,可得到固体64.8kg.
点评 根据图表中剩余固体的质量,分析每次加入相同稀盐酸所减少的质量即样品中被反应掉碳酸钙的质量,判断出第四次加稀盐酸后碳酸钙完全反应,此为本题的突破口.

| A. | 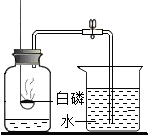 研究空气中氧气含量 | B. | 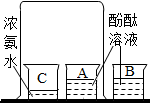 研究分子的运动 | ||
| C. | 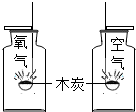 研究木炭在氧气中燃烧 | D. | 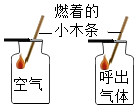 研究空气和呼出气体中氧气的含量 |
 阅读下面科普短文(原文作者:许谦,有删改)
阅读下面科普短文(原文作者:许谦,有删改)酸奶口感酸甜,营养丰富,是深受人们喜爱的一种乳制品.与普通牛奶比较,酸奶中的蛋白质和钙更易被人体消化吸收,是乳糖不耐症患者的良好食品.
通常的酸奶是将牛奶发酵而制成的.牛奶中主要含有蛋白质、乳糖和脂肪.在发酵过程中,乳酸菌把乳糖(C12H22O11)转化成乳酸(C3H6O3),使得牛奶的酸度升高.随着酸度增加,蛋白质分子互相连接,形成了一个巨大的“网络”,这个“蛋白质网络”把乳糖、水、脂肪颗粒都“网”在其中.所以,奶变“粘”、变“酸”了.
酸奶中含有大量活力较强的乳酸菌.乳酸菌可抑制某些腐败菌和病原菌的繁殖,从而维持人体内,尤其是肠道内正常的微生态平衡,促进食物的消化吸收.酸奶在储藏和配送过程中,乳酸菌的数量会因乳酸的过量积聚而明显减少,而酸奶的乳酸积聚又会影响到酸奶的酸度.有研究者选取某种市面常见的酸奶进行实验,数据如下表所示.
表 某品牌酸奶酸度的变化
| 温度/℃ 时间/天 酸度/°T | 4 | 28 | 37 |
| 0 | 67.7 | 67.7 | 67.7 |
| 2 | 73.9 | 77.1 | 79.2 |
| 4 | 76.4 | 82.7 | 86.3 |
| 6 | 85.5 | 92.2 | 98.9 |
| 8 | 90.2 | 98.7 | 113.2 |
依据文章内容回答下列问题.
(1)乳酸是由乳糖转化生成的,请比较二者的化学式,分析它们的相同点和不同点.
相同点:组成元素的种类相同(或原子种类相同).
不同点:各元素的质量比不同(或原子个数比不同).
(2)实验中所用酸奶若在37℃条件下储存,D天后,酸度一定会超出一般人的接受程度.(填字母序号,下同)
A.2 B.4 C.5 D.8
(3)由表中实验数据可知,影响酸奶酸度的因素有温度、时间.
(4)下列关于酸奶的说法正确的是AD.
A.酸奶适用于乳糖不耐症患者食用
B.酸奶放置时间越长,乳酸菌含量越高
C.酸奶中的乳酸菌对人类身体有害无益
D.酸奶变“粘”与蛋白质分子相互连接形成巨大“网络”有关.

| A. | 苹果汁 | B. | 牛奶 | C. | 肥皂水 | D. | 炉具清洁剂 |
 如图3个实验都与铁的性质有关,请回答相关问题.
如图3个实验都与铁的性质有关,请回答相关问题. 请回忆课堂上与同学们讨论的下列问题:
请回忆课堂上与同学们讨论的下列问题: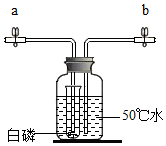 用如图所示装置研究白磷和氧气的反应,装置中试管内液面与试管外相平.
用如图所示装置研究白磷和氧气的反应,装置中试管内液面与试管外相平.