题目内容
9. 实验室中有一瓶长期使用的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行探究.
实验室中有一瓶长期使用的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行探究.发现问题】该样品中含有哪些物质?
【查阅资料】①NaOH在空气中不会转化成NaHCO3.
②BaCl2溶液呈中性,Ba(OH)2是可溶性碱
③CO2在饱和的NaHCO3溶液中几乎不溶解
【提出猜想】
猜想Ⅰ:NaOH
猜想Ⅱ:Na2CO3
猜想Ⅲ:NaOH和Na2CO3
【设计实验】
| 实验操作 | 实验现象 |
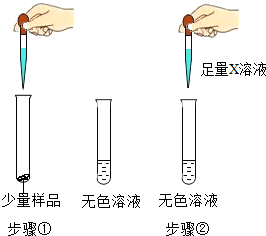 | 步骤①:样品全部溶解 步骤②:观察到现象A |
(2)若X溶液为BaCl2溶液,现象A是有白色沉淀生成,则产生沉淀的化学方程式是BaCl2+Na2CO3═BaCO3↓+2NaCl,取反应后的上层清液,测定其PH,当PH>7(填“>”、“<”或“=”),则证明猜想Ⅲ成立.
【定量分析】确定部分变质样品中Na2CO3的质量分数.
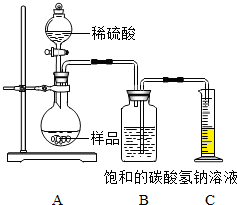
兴趣小组的同学用如图所示装置进行实验.
步骤如下:①按图连接好装置,并检查气密性;②准确称取该样品1.0g,放入烧瓶内;③打开活塞,滴加30.0%的稀硫酸至过量,关闭活塞;④反应结束后,量筒内液体的读数为55.0mL.(已知:室温条件下,CO2的密度为1.6g•L-1)
(1)B装置集气瓶内原有的空气对实验结果没有(填“有”或“没有”)影响.饱和NaHCO3溶液如果用水代替,则所测CO2体积偏小(填“偏大”、“偏小”或“不变”).
(2)计算该样品中Na2CO3的质量分数(写出计算过程,计算结果保留一位小数)
【实验反思】有同学指出,上述三种猜想并不全面,请再提出一种猜想NaOH、Na2CO3、H2O.
分析 【收集证据】(1)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳进行分析;
(2)根据氯化钡和碳酸钠会生成碳酸钡沉淀和氯化钠,以及猜想Ⅲ中含有碳酸钠、氢氧化钠进行分析;
【定量分析】(1)根据二氧化碳在空气中的含量进行分析;
根据二氧化碳会与水反应,易溶于水进行分析;
根据碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳,结合题中的数据进行解答;
【实验反思】根据题中的猜想进行分析.
解答 解:【收集证据】(1)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,所以现象A是有气泡产生,则X溶液为稀盐酸,则猜想Ⅰ成立;
(2)氯化钡和碳酸钠会生成碳酸钡沉淀和氯化钠,化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl,猜想Ⅲ中含有碳酸钠、氢氧化钠,所以取反应后的上层清液,测定其pH>7;
【定量分析】(1)由于装置内的空气不会导致进入右侧的水增加,所装置内空气中含有的二氧化碳,不会对结果产生大的影响;
二氧化碳会与水反应,易溶于水,所以饱和NaHCO3溶液如果用水代替,则所测CO2体积偏小;
设参加反应的碳酸钠是X,
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 55mL×1.6g/L
$\frac{106}{x}$=$\frac{44}{55mL÷1000×1.6g/L}$
x=0.212g
所以该样品中Na2CO3的质量分数为:$\frac{0.212g}{1g}$×100%=21.2%;
【实验反思】通过分析题中的猜想可知,再提出的一种猜想是:NaOH、Na2CO3、H2O.
故答案为:【收集证据】(1)稀盐酸,猜想Ⅰ;
(2)BaCl2+Na2CO3═BaCO3↓+2NaCl,>;
【定量分析】(1)没有;偏小;21.2%;
【实验反思】NaOH、Na2CO3、H2O.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的知识进行解答.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. | 在纯氧中燃烧的现象 | |
| B. | 与盐酸反应的快慢程度 | |
| C. | 金属导电性强弱 | |
| D. | 三种金属发现和利用的年代的先后顺序 |
 实验装置如图所示,其气密性良好.若要使B中尖嘴导管有“喷泉”产生,则A加入的固体和液体不可能是 ( )
实验装置如图所示,其气密性良好.若要使B中尖嘴导管有“喷泉”产生,则A加入的固体和液体不可能是 ( )| A. | 氯化钠和水 | B. | 碳酸钙和稀盐酸 | ||
| C. | 二氧化锰和过氧化氢溶液 | D. | 镁和稀硫酸 |
| A. | 食醋 | B. | 啤酒 | C. | 生铁 | D. | 冰水 |
①纸张 ②塑料 ③玻璃 ④金属.
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |