题目内容
18. 为测定实验室中某过氧化氢溶液的溶质质量分数,取100.0g过氧化氢溶液放入小烧杯中,然后进行如图所示的实验.请计算:
为测定实验室中某过氧化氢溶液的溶质质量分数,取100.0g过氧化氢溶液放入小烧杯中,然后进行如图所示的实验.请计算:①反应后产生气体的物质的量0.1mol.
②该过氧化氢溶液的溶质质量分数6.8%.(请根据化学方程式列式计算)
分析 (1)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.因此完全反应后,物质减少的质量就是生成的气体质量,在求出物质的量;
(2)根据过氧化氢分解的化学方程式和(1)中计算出的氧气的质量,就可计算出参与反应的过氧化氢的质量.
解答 解:(1)根据质量守恒定律,反应生成氧气的质量=230g-226.8g=3.2g.
氧气的物质的量为:$\frac{3.2g}{32g/mol}$=0.1mol;
答:(1 )生成氧气的质量是3.2g;(2)溶液中过氧化氢的质量为6.8g;解:(1)0.1mol
(2)设:含H2O2的物质的量为Xmol.
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
2 1
Xmol 0.1mol
$\frac{2}{1}=\frac{Xmol}{0.1mol}$ 解得:X=0.2mol
过氧化氢的质量为:0.2mol×34g/mol=6.8g
过氧化氢溶液的质量分数为$\frac{6.8g}{100.0g}×100%$=6.8%
故答为:(1)0.1mol;(2)6.8%.
点评 本题主要考查学生根据质量守恒定律,运用化学方程式和质量分数公式进行计算的能力.

练习册系列答案
相关题目
16.下列四个图象分别对应四个变化过程,其中正确的是( )
| A. |  服用胃舒平[主要成分Al(OH)3]治疗胃酸过多(胃液pH随时间变化图) | |
| B. |  向氢氧化钠和碳酸钠的混合溶液中加入稀盐酸溶液直至过量 | |
| C. |  常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应 | |
| D. |  将一定质量的硝酸钾不饱和溶液恒温蒸发水份,直至有少量晶体析出 |
6.生活中处处有化学.下列说法错误的是( )
| A. | 为使发面食品松软可口,制作时可添加适量碳酸氢钠 | |
| B. | 合理使用加碘盐有利于碘缺乏症病人健康 | |
| C. | 食用甲醛水溶液浸泡过的海产品对人身体无害 | |
| D. | 香烟的烟气中含有很多对人体有害的物质 |
10.氢氧化钙是一种建筑材料,它的俗名是( )
| A. | 生石灰 | B. | 石灰水 | C. | 熟石灰 | D. | 大理石 |
7.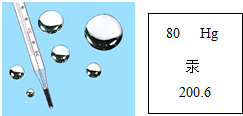 汞是银白色闪亮的重质液体,化学性质稳定,不溶于酸也不溶于碱.汞常温下即可蒸发,汞蒸发气和汞的化合物多有剧毒(慢性).汞使用的历史很悠久,用途很广泛,如图是汞在元素周期表中的相关信息,关于汞的说法正确的是( )
汞是银白色闪亮的重质液体,化学性质稳定,不溶于酸也不溶于碱.汞常温下即可蒸发,汞蒸发气和汞的化合物多有剧毒(慢性).汞使用的历史很悠久,用途很广泛,如图是汞在元素周期表中的相关信息,关于汞的说法正确的是( )
 汞是银白色闪亮的重质液体,化学性质稳定,不溶于酸也不溶于碱.汞常温下即可蒸发,汞蒸发气和汞的化合物多有剧毒(慢性).汞使用的历史很悠久,用途很广泛,如图是汞在元素周期表中的相关信息,关于汞的说法正确的是( )
汞是银白色闪亮的重质液体,化学性质稳定,不溶于酸也不溶于碱.汞常温下即可蒸发,汞蒸发气和汞的化合物多有剧毒(慢性).汞使用的历史很悠久,用途很广泛,如图是汞在元素周期表中的相关信息,关于汞的说法正确的是( )| A. | 汞属于非金属元素 | |
| B. | 汞原子中质子与中子数之和为200.6 | |
| C. | 汞原子中电子数为80 | |
| D. | 汞不能与其他物质发生化学反应 |
 某碳酸钠样品中含少量氯化钠,化学兴趣小组的同学欲通过实验来测定样品中碳酸钠的质量分数.他们取5g该样品,配制成溶液,再向其中加入足量的氯化钙溶液(呈中性),测得加入氯化钙溶液的质量与产生沉淀的质量关系如图所示.请回答下列问题:
某碳酸钠样品中含少量氯化钠,化学兴趣小组的同学欲通过实验来测定样品中碳酸钠的质量分数.他们取5g该样品,配制成溶液,再向其中加入足量的氯化钙溶液(呈中性),测得加入氯化钙溶液的质量与产生沉淀的质量关系如图所示.请回答下列问题: