题目内容
7. 汞是银白色闪亮的重质液体,化学性质稳定,不溶于酸也不溶于碱.汞常温下即可蒸发,汞蒸发气和汞的化合物多有剧毒(慢性).汞使用的历史很悠久,用途很广泛,如图是汞在元素周期表中的相关信息,关于汞的说法正确的是( )
汞是银白色闪亮的重质液体,化学性质稳定,不溶于酸也不溶于碱.汞常温下即可蒸发,汞蒸发气和汞的化合物多有剧毒(慢性).汞使用的历史很悠久,用途很广泛,如图是汞在元素周期表中的相关信息,关于汞的说法正确的是( )| A. | 汞属于非金属元素 | |
| B. | 汞原子中质子与中子数之和为200.6 | |
| C. | 汞原子中电子数为80 | |
| D. | 汞不能与其他物质发生化学反应 |
分析 根据汞元素在元素周期表中的相关信息,进行分析解答.
解答 解:A.汞是唯一是液态的金属,汞属于金属元素,故A说法不正确;
B.根据相对原子质量≈质子数+中子数,由汞元素在元素周期表可知汞相对原子质量为200.6,故汞原子中质子与中子数之和为整数约为201;故B说法不正确;
C.根据在原子中,原子序数=质子数=核电荷数=核外电子数,可知汞原子核外有80个电子;故C说法正确;
D.汞的化学性质稳定,汞不易与其他物质发生化学反应,故D说法不正确;
故选C.
点评 本题主要考查元素在元素周期表中的相关信息的运用,注意:相对原子质量是有单位的,其单位为“1”,只不过常省略而已.

练习册系列答案
相关题目
17.有三瓶无色、无味的气体x、y、z,它们分别是甲烷、氢气、一氧化碳中的一种,分别点燃三种气体,用干燥的冷烧杯罩在火焰上方,只有y和z只火焰上方的烧杯内壁有水滴出现,燃烧后分别向烧杯中注入澄清的石灰水,振荡,只有x和y的烧杯内石灰水变浑浊.则x、y、z分别是( )
| A. | CO CH4 H2 | B. | CH4 CO H2 | C. | CH4 H2 CO | D. | H2 CH4 CO |
15.下列化学方程式中,书写正确的是( )
| A. | 2H2O→2H2↑+O2↑ | B. | H2SO4+NaOH→NaSO4+H2O | ||
| C. | Fe+HCl→FeCl2+H2↑ | D. | Ca(HCO3)2$\stackrel{△}{→}$CaCO3↓+CO2↑+H2O |
16.碳酸钠和碳酸氢钠是生活中常见的两种白色固体.同学们对鉴别这两种物质非常感兴趣,进行如下探究.
【查阅资料】
1.碳酸钠和碳酸氢钠在不同温度下的溶解度
2.碳酸钠和碳酸氢钠化学性质(部分)的比较
【设计方案并实施】
 【实验反思】
【实验反思】
通过上述实验,我们了解依据物质的性质设计并进行对比实验,能帮助我们更好地理解和掌握相关物理的性质.
【查阅资料】
1.碳酸钠和碳酸氢钠在不同温度下的溶解度
| 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3 | 12.5 g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.lg | I2.7g |
| 性质 | Na2CO3 | NaHCO3 | 性质比较 |
| 溶液的酸碱性 | 碱性 | 碱性 | 相铜条件下,Na2C03溶液的碱性更强 |
| 热稳定性 | 稳定 | 不稳定 | NaHCO3受热分解生成Na2C03、C02 和H20 |
| 与盐酸反应 | 反应 | 反应 | 均产生CO2,但NaHCO3与盐酸的反应更加剧烈 |
| 实验方案 | 实验现象及结论 1 |
| 方案一:20℃时,在100 g水中加入11 g该白色固体,充分溶解 | 若有白色固体剩余,样品为碳酸氢钠; 否则为碳酸钠. |
| 方案二:分别将两种待测固体溶于水制成5%的溶液,用玻璃棒分别蘸取少量待测液于pH试纸上,静置,观察现象 | pH值大的为碳酸钠溶液,pH值小的为碳酸氢钠溶液. |
| 方案三:分别取少量固体于試管中加热,将产生的气体通入澄清的石灰水中. | 若石灰水变浑浊,样品为碳酸氢钠,否则为碳酸钠. |
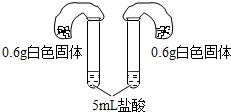
| 方案四:如阁所示,分别将气球中的白色固体全部且同时倒入装有盐酸的试管中,观察现象. | 气球胀大速度快且大的,原固体为碳酸氢钠,否则为碳酸钠 |
 【实验反思】
【实验反思】通过上述实验,我们了解依据物质的性质设计并进行对比实验,能帮助我们更好地理解和掌握相关物理的性质.
 为测定实验室中某过氧化氢溶液的溶质质量分数,取100.0g过氧化氢溶液放入小烧杯中,然后进行如图所示的实验.请计算:
为测定实验室中某过氧化氢溶液的溶质质量分数,取100.0g过氧化氢溶液放入小烧杯中,然后进行如图所示的实验.请计算:

 如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:(1)P点的含义是t1℃时a与c的溶解度相等.
如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:(1)P点的含义是t1℃时a与c的溶解度相等.