题目内容
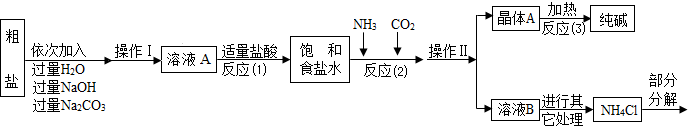
19.连云港市制碱厂是中国三大纯碱生产企业之一,某校化学兴趣小组参观后,获得以下信息并对相关问题进行研究.【查阅资料】①生产原料粗盐中含有少量可溶性杂质(MgCl2和CaC12)及不溶性杂质.
②生产原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4C1.分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物.
③氯化铵分解的化学方程式是NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑.
④部分生产流程如下图所示:
【问题讨论】
(1)①写出加入NaOH溶液所发生反应的化学方程式MgCl2+2NaOH═Mg(OH)2↓+2NaCl.
②操作Ⅱ的名称为过滤.
③流程中Na2CO3溶液的作用是除去粗盐中的氯化钙.
④写出晶体A受热分解的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(2)上述生产流程中可循环使用的是ACD (填序号).
A.NH3 B.NaOH C.HCl D.CO2
【组成探究】
(3)取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为NaCl+AgNO3═AgCl↓+NaNO3,由此确定纯碱样品含有杂质NaCl.
(4)同学们为了测定该纯碱样品的纯度,设计了如下实验:
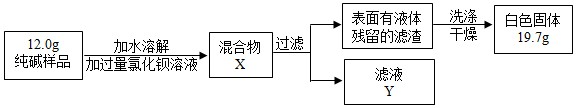
①化钡溶液过量的目的是使碳酸钠完全反应.
②根据实验数据,计算样品中碳酸钠的质量分数.(写出解题过程,精确到0.1% )
分析 (1)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠;
操作Ⅱ的名称是过滤,通过过滤把液体和固体分离;
碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠;
碳酸氢钠受热分解碳酸钠、水和二氧化碳;
(2)根据生产流程中可判断循环使用的物质种类;
(3)氯化钠和硝酸银反应生成白色沉淀氯化银和硝酸钠;
(4)根据反应的化学方程式及其提供的数据可以进行行股份密度计算和判断.
解答 解:(1)①加入NaOH溶液时,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,所发生反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl.
故填:MgCl2+2NaOH═Mg(OH)2↓+2NaCl.
②操作Ⅱ的名称为过滤,通过过滤把液体和固体分离.
故填:过滤.
③流程中Na2CO3溶液的作用是除去粗盐中的氯化钙.
故填:氯化钙.
④晶体A是碳酸氢钠,受热分解的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
故填:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(2)上述生产流程中可循环使用的是氨气、盐酸和二氧化碳.
故选:ACD.
(3)取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀,说明纯碱样品含有杂质NaCl,氯化钠和硝酸银反应生成白色沉淀氯化银和硝酸钠,产生沉淀的方程式为:NaCl+AgNO3═AgCl↓+NaNO3.
故填:NaCl+AgNO3═AgCl↓+NaNO3.
(4)①化钡溶液过量的目的是使碳酸钠完全反应.
故填:使碳酸钠完全反应.
②设碳酸钠质量为x,
BaCl2+Na2CO3═BaCO3↓+2NaCl,
106 197
x 19.7g
$\frac{106}{x}$=$\frac{197}{19.7g}$,
x=10.6g,
样品中碳酸钠的质量分数为:$\frac{10.6g}{12.0g}$×100%=88.3%,
答:样品中碳酸钠的质量分数为88.3%.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

 阅读快车系列答案
阅读快车系列答案①生产原理:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(固体)↓+NH4Cl
②主要生产流程如图所示:

下列叙述不正确的是( )
| A. | 该过程操作1的名称是过滤 | |
| B. | 该工艺流程可看出:该温度下碳酸氢钠的溶解度大于氯化铵的溶解度 | |
| C. | 该过程涉及的物质中元素的化合价不发生改变 | |
| D. | 图中反应2的化学方程式是2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O |
| A. | 先通氨气是因为氨气在水中的溶解度远大于二氧化碳在水中的溶解度,这有利于反应进行 | |
| B. | 析出NaHCO3晶体后,溶液为NaHCO3的不饱和溶液 | |
| C. | 该条件下NaHCO3的溶解度比NH4Cl大 | |
| D. | 析出晶体后剩余溶液中只有一种溶质 |

(说明:沉淀池发生的主要反应:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl )
下列有关说法错误的是( )
| A. | 流程中操作a名称是过滤 | B. | 反应①属于分解反应 | ||
| C. | 可循环利用的物质X是CO2 | D. | “母液”中一定只含有两种溶质 |

| A. | ①加土壤颗粒 | B. | ②加水溶解 | ||
| C. | ③振荡试管 | D. | ④用玻璃棒蘸取清液 |
 有A、B、C、D、E、F、G七种不同化合物,它们有如图所示的反应关系(图中的“-”表示相连两物质之间可以发生反应,图中的“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去).已知:B和D,C和E,F和G分别为相同类型的物质;A是胃酸的主要成分,F为红色固体.请写出:
有A、B、C、D、E、F、G七种不同化合物,它们有如图所示的反应关系(图中的“-”表示相连两物质之间可以发生反应,图中的“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去).已知:B和D,C和E,F和G分别为相同类型的物质;A是胃酸的主要成分,F为红色固体.请写出: 小红同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿后,采用如图所示装置进行过滤,请问:
小红同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿后,采用如图所示装置进行过滤,请问: 如图是A、B、C三种物质的溶解度曲线,据图回答:
如图是A、B、C三种物质的溶解度曲线,据图回答: