题目内容
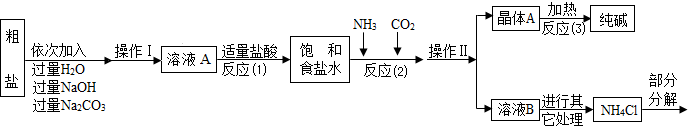
12. 有A、B、C、D、E、F、G七种不同化合物,它们有如图所示的反应关系(图中的“-”表示相连两物质之间可以发生反应,图中的“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去).已知:B和D,C和E,F和G分别为相同类型的物质;A是胃酸的主要成分,F为红色固体.请写出:
有A、B、C、D、E、F、G七种不同化合物,它们有如图所示的反应关系(图中的“-”表示相连两物质之间可以发生反应,图中的“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去).已知:B和D,C和E,F和G分别为相同类型的物质;A是胃酸的主要成分,F为红色固体.请写出:①F的化学式为Fe2O3;
②写出A与F反应的化学方程式6HCl+Fe2O3=2FeCl3+3H2O;C→G的化学反应方程式CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
分析 根据A、B、C、D、E、F、G七种不同化合物,A是胃酸的主要成分,所以A是盐酸,F为红色固体,A会与F反应,所以F是氧化铁,F会转化成G,所以G是二氧化碳,B和D,C和E,F和G分别为相同类型的物质,所以E可以是碳酸钠,C可以是碳酸钙,盐酸会与D反应,所以D可以是氢氧化钠,B可以是氢氧化钙,然后将推出的物质进行验证即可.
解答 解:①A、B、C、D、E、F、G七种不同化合物,A是胃酸的主要成分,所以A是盐酸,F为红色固体,A会与F反应,所以F是氧化铁,F会转化成G,所以G是二氧化碳,B和D,C和E,F和G分别为相同类型的物质,所以E可以是碳酸钠,C可以是碳酸钙,盐酸会与D反应,所以D可以是氢氧化钠,B可以是氢氧化钙,经过验证,推导正确,所以F是Fe2O3;
②A与F的反应是盐酸和氧化铁反应生成氯化铁和水,化学方程式为:6HCl+Fe2O3=2FeCl3+3H2O,C→G的反应是碳酸钙在高温的条件下生成氧化钙和二氧化碳,化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
故答案为:①Fe2O3;
②6HCl+Fe2O3=2FeCl3+3H2O,CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.如图表示两种物质在一定条件下发生的化学变化,其中相同的球代表同种原子,小球间的短线代表原子间的结合,下列说法正确的是( )


| A. | 图示中微观粒子中只有三种分子 | |
| B. | 图示中物质没有单质 | |
| C. | 通过该化学变化生成了两种化合物 | |
| D. | 图示化学变化中,变化前后分子、原子种类都不变 |
7.已知M、N在一定条件下,能发生反应:M+2N=P+2Q,则下列说法中不正确的是( )
| A. | 若M、N、P、Q都是由分子构成的物质,则该反应前后分子的数目一定不变 | |
| B. | M、N、P、Q可能含有同一种元素 | |
| C. | 若M、N、P、Q都是化合物,则该反应一定是复分解反应 | |
| D. | 若16g M和64g N能恰好完全反应,则M、N的相对分子质量之比为1:2 |