题目内容
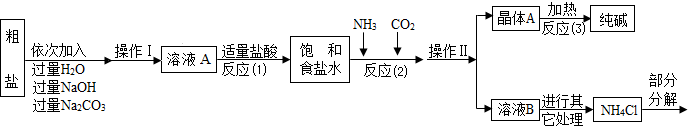
10.“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.①生产原理:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(固体)↓+NH4Cl
②主要生产流程如图所示:

下列叙述不正确的是( )
| A. | 该过程操作1的名称是过滤 | |
| B. | 该工艺流程可看出:该温度下碳酸氢钠的溶解度大于氯化铵的溶解度 | |
| C. | 该过程涉及的物质中元素的化合价不发生改变 | |
| D. | 图中反应2的化学方程式是2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O |
分析 A、过滤是将固体和液体分离开来的一种操作,据此分析.
B、该温度下碳酸氢钠先析出,说明该温度下碳酸氢铵的溶解度小于氯化铵的溶解度,据此分析.
C、该过程涉及两个化学反应,一个是氯化钠、水、氨气和二氧化碳反应生成氯化铵和碳酸氢钠,一个是碳酸氢钠分解生成氯化钠、水和二氧化碳,据此分析.
D、图中反应2是碳酸氢钠分解生成氯化钠、水和二氧化碳,据此分析.
解答 解:A、过滤是将固体和液体分离开来的一种操作,因此操作1的名称是过滤,故说法正确.
B、该温度下碳酸氢钠先析出,说明该温度下碳酸氢铵的溶解度小于氯化铵的溶解度,故说法错误.
C、该过程涉及两个化学反应,一个是氯化钠、水、氨气和二氧化碳反应生成氯化铵和碳酸氢钠,一个是碳酸氢钠分解生成氯化钠、水和二氧化碳,这两个反应中各元素的化合价都不发生改变,故说法正确.
D、图中反应2是碳酸氢钠分解生成氯化钠、水和二氧化碳,其化学方程式是2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,故说法正确.
故选B.
点评 此题难度不大,掌握“侯氏制碱法”的有关知识以及化合价原则等即可顺利解答.

练习册系列答案
相关题目
3.如图表示两种物质在一定条件下发生的化学变化,其中相同的球代表同种原子,小球间的短线代表原子间的结合,下列说法正确的是( )


| A. | 图示中微观粒子中只有三种分子 | |
| B. | 图示中物质没有单质 | |
| C. | 通过该化学变化生成了两种化合物 | |
| D. | 图示化学变化中,变化前后分子、原子种类都不变 |
15.下列说法中正确的是( )
| A. | 红磷在氧气中能燃烧,在空气中不能燃烧 | |
| B. | 铁丝在空气中燃烧时,火星四射,生成黑色固体 | |
| C. | 硫在氧气中燃烧后生成有刺激性气味的气体 | |
| D. | 木炭伸入盛有氧气的集气瓶中剧烈燃烧,发出白光 |

 如图,在盛有少量石灰石的试管中加入适量的稀盐酸,实验中出现的现象是:①白色固体表面有气泡产生,固体逐渐减少,烧杯中导管口有气泡产生,澄清石灰水变白色浑浊;烧杯内导管口出现气泡的原因:石灰石与稀盐酸反应,生成②二氧化碳气体,使试管内③气体增多,气压④增大,⑤大于外界大气压,在⑥压强差的作用下导管口有气泡产生.
如图,在盛有少量石灰石的试管中加入适量的稀盐酸,实验中出现的现象是:①白色固体表面有气泡产生,固体逐渐减少,烧杯中导管口有气泡产生,澄清石灰水变白色浑浊;烧杯内导管口出现气泡的原因:石灰石与稀盐酸反应,生成②二氧化碳气体,使试管内③气体增多,气压④增大,⑤大于外界大气压,在⑥压强差的作用下导管口有气泡产生.