题目内容
19.张南同学取来某种品牌的胃药30g放入烧杯中,再加入82g的稀盐酸,充分反应后所得混合物的质量为103.2g,此时溶液的pH.7.若此胃药中只含氢氧化铝、氧化镁、碳酸氢钠等常见的治疗胃病药剂中的一种.且胃药中的其他成分不与盐酸反应也不溶于水.试回答:(1)此胃药中含有的治疗胃病药剂是碳酸氢钠
(2)发生反应的化学方程式是NaHCO3+HCl=NaCl+H2O+CO2↑
(3)列出参加反应的药剂质量(x)的比例式为$\frac{84}{x}=\frac{44}{8.8g}$
(4)反应后所得溶液溶质的质量分数是13%.
分析 理解酸的化学性质及能够和酸反应的常见的物质,并能进行简单的有关的计算.
解答 解:(1)30克胃药与80克盐酸混合,充分反应后只得到103.2克混合物,少了8.8克,说明生成了8.8气体,由于在氢氧化铝、氧化镁、碳酸氢钠,只有碳酸氢钠与盐酸反应能生成气体.故答案为:碳酸氢钠
(2)由于碳酸氢钠与稀盐酸反应生成氯化钠、二氧化碳和水,故答案为:NaHCO3+HCl=NaCl+H2O+CO2↑
(3)该题的具体过程为:设参加反应的药剂即碳酸氢钠的质量为X,生成的氯化钠的质量为Y.
NaHCO3+HCl=NaCl+H2O+CO2↑
84 58.5 44
X Y 8.8g
$\frac{84}{X}=\frac{58.5}{Y}=\frac{44}{8.8g}$
x═16.8g
y═11.7g
所的溶液中溶质的质量分数为:$\frac{11.7g}{103.2g-(30g-16.8g)}$×100%═13%
故答案为:$\frac{84}{x}=\frac{44}{8.8g}$
(4)13%.
点评 主要考查了酸的化学性质,常见化学方程式的书写,培养学生分析问题、解决问题、计算的能力.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
8.化学的发展对改善人们的生存环境和促进社会发展有着积极的作用,下列各项利用化学变化与其多达到的目的不相符的是( )
| A. | 合成药物 抑制细菌和病毒 | |
| B. | 生产化肥、农药 增加粮食产量 | |
| C. | 开发新材料、新能源 改善生存条件,提高生活质量 | |
| D. | 合成食品添加剂 增进人体健康 |

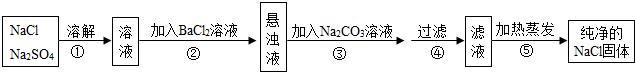
 如图是钠元素的相关信息,钠元素位于元素周期表第三周期,钠原子在化学反应中易失去(填“得到”或“失去”)电子.
如图是钠元素的相关信息,钠元素位于元素周期表第三周期,钠原子在化学反应中易失去(填“得到”或“失去”)电子. 溶解度曲线为我们定量描述物质的溶解性强弱提供了便利.请你根据如图的溶解度曲线回答下列问题:
溶解度曲线为我们定量描述物质的溶解性强弱提供了便利.请你根据如图的溶解度曲线回答下列问题: