题目内容
14.化工生产中需要对原料提纯,以利于提高产品质量.经测定某氯化钠样品中混有硫酸钠,为了除杂质并制得纯净的氯化钠固体,在实验室研究中某学生设计方案如下: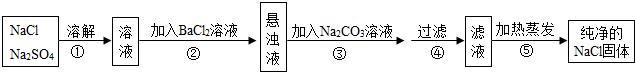
回答下列问题.
(1)步骤③中反应的化学方程式BaCl2+Na2CO3═BaCO3↓+2NaCl;
(2)操作②能否用硝酸钡溶液?说明理由不能,因为如果利用硝酸钡溶液,则会带入杂质硝酸钠;
(3)进行操作②后,如何判断硫酸钠已除尽,方法是取上层清液适量于试管中,滴加氯化钡溶液,如果不产生白色沉淀,说明硫酸钠已除尽;
(4)操作③的目的是除去过量的氯化钡,③、④操作顺序能否交换,其理由是不能颠倒,这是因为如果颠倒顺序,则反应生成的碳酸钡沉淀无法除去;
(5)此设计方案是否严密,说明理由不严密,这是因为加入的碳酸钠溶液应该是足量的,会导致过量的碳酸钠无法除去.
分析 氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠;
硝酸钡和硫酸钠反应生成硫酸钡沉淀和硝酸钠,和碳酸钠反应生成碳酸钡沉淀和硝酸钠;
氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠;
碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳.
解答 解:(1)步骤③中氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠,反应的化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl.
故填:BaCl2+Na2CO3═BaCO3↓+2NaCl.
(2)因为如果利用硝酸钡溶液,则会带入杂质硝酸钠,所以操作②不能用硝酸钡溶液.
故填:不能,因为如果利用硝酸钡溶液,则会带入杂质硝酸钠.
(3)进行操作②后,判断硫酸钠已除尽的方法是:取上层清液适量于试管中,滴加氯化钡溶液,如果不产生白色沉淀,说明硫酸钠已除尽.
故填:取上层清液适量于试管中,滴加氯化钡溶液,如果不产生白色沉淀,说明硫酸钠已除尽.
(4)操作③的目的是除去过量的氯化钡;
③、④操作顺序不能交换,其理由是如果颠倒顺序,则反应生成的碳酸钡沉淀无法除去.
故填:除去过量的氯化钡;不能颠倒,这是因为如果颠倒顺序,则反应生成的碳酸钡沉淀无法除去.
(5)此设计方案不严密,理由是:因为加入的碳酸钠溶液应该是足量的,会导致过量的碳酸钠无法除去.
故填:不严密,这是因为加入的碳酸钠溶液应该是足量的,会导致过量的碳酸钠无法除去.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
4.在下表的空格内写出相应的化学符号或意义.
| 化学符号 | $\stackrel{+3}{Fe}$ | 2Mg | P | 3N2 | Ag |
| 表示意义 | +3价的 铁元素 | 2个镁原子 | 磷元素 | 3个氮分子 | 单质银 |
9.某化学兴趣小组为了测定黄金山石灰石中碳酸钙的含量,进行了如下实验:取一定量的石灰石样品与一定量的稀盐酸放入烧杯内,两者恰好完全反应(杂质不溶也不参与反应),具体数据如下表.
(1)该反应是否遵循质量守恒定律遵循(填“遵循”或“不遵循”)
(2)样品中碳酸钙的质量为5克
(3)求反应后所得溶液溶质的质量分数?
| 反应前 | 反应后 |
| 石灰石样品质量6.0克 | 杯内物质总质量 63.8克 |
| 稀盐酸质量60.0克 | |
| 烧杯质量100.0克 | 烧杯质量100.0克 |
(2)样品中碳酸钙的质量为5克
(3)求反应后所得溶液溶质的质量分数?
3.下列的物质的分类正确的是( )
| A. | 氯化钠和氯化铵都属于盐类 | B. | 合金和合成纤维都属于合成材料 | ||
| C. | 火碱和纯碱都属于碱类 | D. | 葡萄糖和碳酸钾都属于有机化合物 |
4.“酒香不怕巷子深”这句俗语说明( )
| A. | 在化学变化中,分子可分,而原子却不能再分 | |
| B. | 分子在不停地运动 | |
| C. | 分子由原子构成 | |
| D. | 分子的体积在变大 |