题目内容
5.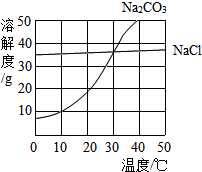 (1)30℃时,氯化钠的溶解度=碳酸钠的溶解度(填写“>”、“<”或“=”);
(1)30℃时,氯化钠的溶解度=碳酸钠的溶解度(填写“>”、“<”或“=”);(2)10℃时,碳酸钠饱和溶液的质量分数是9.1%;
(3)40℃时,将接近饱和碳酸钠溶液迅速降温到至20℃,发现溶液中有晶体析出,此溶液是碳酸钠的饱和溶液(填“饱和”或“不饱和”).
分析 (1)根据溶解度的大小比较方法考虑;(2)根据饱和溶液的溶质质量分数计算方法考虑;(3)根据降温后析出晶体考虑.
解答 解:(1)据图可以看出,30℃时,氯化钠的溶解度等于碳酸钠的溶解度,故填:=;
(2)10℃时,碳酸钠的溶解度为10g,其饱和溶液的质量分数是$\frac{10g}{100g+10g}×100%≈9.1%$,故填:9.1%;
(3)有晶体析出,说明溶液变为饱和溶液,故填:饱和.
点评 解答本题关键是要知道溶解度的查法,知道溶解度大小的比较方法以及饱和溶液溶质质量分数的计算方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.我国曾发生过多次将工业用盐如亚硝酸钠(NaNO2)误作食盐用于烹调而引起的中毒事件,关于亚硝酸钠的说法正确的是( )
| A. | 亚硝酸中钠、氧元素的质量比为23:32 | |
| B. | 亚硝酸钠中氧元素的质量分数最小 | |
| C. | 亚硝酸钠是氧化物 | |
| D. | 亚硝酸钠中氮元素化合价为+5价 |
16.食品工业中做面点时,常用到一种既能减少面粉发酵产生的酸,又能使面包松软的白色物质是( )
| A. | 烧碱 | B. | 蔗糖 | C. | 生石灰 | D. | 小苏打 |
13.我国南海海底蕴藏着大量的“可燃冰”,它是天然气和水在低温高压下形成的固态物质,外形晶莹剔透,是一种燃烧值高、清洁无污染的新型能源.下列说法正确的是( )
| A. | 可燃冰是可再生能源 | |
| B. | 可燃冰燃烧时内能转化为化学能 | |
| C. | 可燃冰是核聚变反应生成的 | |
| D. | 开采可燃冰时,如甲烷气体泄漏可造成温室效应 |
20.正确的实验操作对实验结果、人身安全都非常重要.下列实验操作不正确的是( )
| A. |  滴加少量液体 | B. |  测定溶液pH | C. |  称量固体 | D. |  液体过滤 |
10.实验室收集气体时.排水集气法和排空气法中只能采取其中一种方法的一组是( )
①C02 ②C0 ③O2 ④H2.
①C02 ②C0 ③O2 ④H2.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
17.下列说法或做法不合理的是( )
| A. | 向氢氧化钠和稀盐酸的混合溶液中加入锌片没有气泡产生,由此可证明氢氧化钠和稀盐酸发生了化学反应 | |
| B. | 化学反应前后,分子和离子的种类可能发生改变,但原子的种类不变 | |
| C. | 湿衣服在太阳底下干得快,说明分子运动速率与温度有关 | |
| D. | 用玻璃棒蘸取食用白醋滴在湿润的pH试纸上,测定其pH值 |
10. 某纯碱中含有少量氯化钠杂质,为检验其纯度,小周取出27g纯碱样品,平均分成五份,依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应、待气体充分溢出后,用天平称质量(如图),得到如表数据.请计算
某纯碱中含有少量氯化钠杂质,为检验其纯度,小周取出27g纯碱样品,平均分成五份,依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应、待气体充分溢出后,用天平称质量(如图),得到如表数据.请计算
(1)第一次加入纯碱样品充分反应后,生成二氧化碳的质量是2.2g.
(2)计算纯碱样品中碳酸钠的质量分数是多少?(精确到0.1%)
(3)关于所用稀盐酸的质量分数,三位同学做法各不相同(如图).判断谁的做法正确,并分析另两位同学的错误之处.

 某纯碱中含有少量氯化钠杂质,为检验其纯度,小周取出27g纯碱样品,平均分成五份,依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应、待气体充分溢出后,用天平称质量(如图),得到如表数据.请计算
某纯碱中含有少量氯化钠杂质,为检验其纯度,小周取出27g纯碱样品,平均分成五份,依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应、待气体充分溢出后,用天平称质量(如图),得到如表数据.请计算| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入纯碱样品的质量/g | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
| 电子天平的示数/g | 163.2 | 166.4 | 169.6 | 173.9 | 179.3 |
(2)计算纯碱样品中碳酸钠的质量分数是多少?(精确到0.1%)
(3)关于所用稀盐酸的质量分数,三位同学做法各不相同(如图).判断谁的做法正确,并分析另两位同学的错误之处.

