题目内容
13.我国南海海底蕴藏着大量的“可燃冰”,它是天然气和水在低温高压下形成的固态物质,外形晶莹剔透,是一种燃烧值高、清洁无污染的新型能源.下列说法正确的是( )| A. | 可燃冰是可再生能源 | |
| B. | 可燃冰燃烧时内能转化为化学能 | |
| C. | 可燃冰是核聚变反应生成的 | |
| D. | 开采可燃冰时,如甲烷气体泄漏可造成温室效应 |
分析 A、天然气水合物俗称可燃冰,是一种新型能源,贮存于大海深处,其蕴藏量是地球上煤、石油的几百倍,因而是一种等待开发的巨大能源物质.化石燃料属于不可再生能源,属于一次能源;
B、可燃冰燃烧时化学能转化为内能.
C、“可燃冰”又称天然气水合物,它是在海底的高压、低温条件下形成的.
D、造成温室效应的气体有:二氧化碳、甲烷、臭氧.
解答 解:A、“可燃冰”属于一次能源,还属于不可再生能源,不合题意;
B、可燃冰的主要成分是天然气,燃烧时化学能转化为内能.不合题意;
C、可燃冰的学名为“天然气水合物”,是天然气在0℃和30个大气压的作用下结晶而成的“冰块”.“冰块”里甲烷占80%~99.9%,可直接点燃,燃烧后几乎不产生任何残渣,污染比煤、石油、天然气都要小得多.不合题意;
D、造成温室效应的气体有:二氧化碳、甲烷、臭氧,所以符合题意.
故选D.
点评 此题通过可燃冰考查了能源的分类、能源的来源、可燃冰的成分和燃烧时能量转化,是一道综合题,要认真分析.

练习册系列答案
 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
3.化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
【查得资料】(1)该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生.
(2)饱和碳酸氢钠溶液不吸收二氧化碳.
【设计实验】小组同学设计了如图所示装置(图中夹持仪器略去) 测定牙膏样品中碳酸钙的含量.

依据图示回答下列问题:
(1)该装置中氢氧化钠溶液的作用是吸收空气中的二氧化碳.
(2)C中观察到有沉淀产生,反应的化学方程式为CO2+Ba(OH)2=BaCO3↓+H2O.
(3)实验过程中需持续缓缓通入空气,其作用有使反应产生的二氧化碳全部被氢氧化钡溶液吸收.
【解释与结论】实验测得如下数据:
欲计算样品中碳酸钙的含量,应选择的数据是三组数据的平均值.
【反思与评价】
(1)有人认为不必测定C中沉淀的质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是氢氧化钡溶液吸收了挥发出的氯化氢气体.
(2)反思实验过程,小刚同学提出应采取必要措施,提高测定准确度.他提出的下列各项措施中,不能提高测定准确度的是bcd(填字母序号).
a.在加入盐酸之前,排净装置内的CO2气体
b.放慢滴加盐酸的速度
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置.
【查得资料】(1)该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生.
(2)饱和碳酸氢钠溶液不吸收二氧化碳.
【设计实验】小组同学设计了如图所示装置(图中夹持仪器略去) 测定牙膏样品中碳酸钙的含量.

依据图示回答下列问题:
(1)该装置中氢氧化钠溶液的作用是吸收空气中的二氧化碳.
(2)C中观察到有沉淀产生,反应的化学方程式为CO2+Ba(OH)2=BaCO3↓+H2O.
(3)实验过程中需持续缓缓通入空气,其作用有使反应产生的二氧化碳全部被氢氧化钡溶液吸收.
【解释与结论】实验测得如下数据:
| 实验次数 | 样品质量(g) | 所用盐酸质量(g) | 所得沉淀质量(g) |
| 第一次 | 8.00 | 50 | 1.95 |
| 第二次 | 8.00 | 50 | 1.98 |
| 第三次 | 8.00 | 50 | 1.96 |
【反思与评价】
(1)有人认为不必测定C中沉淀的质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是氢氧化钡溶液吸收了挥发出的氯化氢气体.
(2)反思实验过程,小刚同学提出应采取必要措施,提高测定准确度.他提出的下列各项措施中,不能提高测定准确度的是bcd(填字母序号).
a.在加入盐酸之前,排净装置内的CO2气体
b.放慢滴加盐酸的速度
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置.
8.我国大部分地区深受酸雨的危害,煤燃烧产生的SO2是形成酸雨的主要污染物,SO2与水结合生成弱酸性亚硫酸(H2SO3).
已知:H2SO3易分解生成水和SO2,也易与空气中的氧气或稀硝酸反应生成H2SO4;H2SO3和SO2都能使红色的品红溶液褪色.
(1)酸雨是pH小于5.6的降雨.
(2)常用脱硫方法减少废气中的SO2和O2化合生成CaSO4,化学方程式为2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4.
(3)实验室常用亚硫酸盐与HCl或H2SO4反应制备SO2,Na2SO3与盐酸反应的化学方程式为Na2SO3+2HCl═2NaCl+H2O+SO2↑.
(4)小鸿同学利用中和反应的原理,在空气中放置一段时间的酸雨(pH约为3)中加入足量的KOH,并就反应后混合溶液中盐的成分进行如下探究:
【提出猜想】反应后的混合溶液中盐的成分是什么?
猜想1:只有K2SO4
猜想2:只有K2SO3
猜想3:既有K2SO4,也有K2SO3
【实验探究】限选试剂:稀硫酸、稀盐酸、稀硝酸氯化钡溶液、澄清石灰水、红色品红溶液、紫色石蕊溶液.
已知:H2SO3易分解生成水和SO2,也易与空气中的氧气或稀硝酸反应生成H2SO4;H2SO3和SO2都能使红色的品红溶液褪色.
(1)酸雨是pH小于5.6的降雨.
(2)常用脱硫方法减少废气中的SO2和O2化合生成CaSO4,化学方程式为2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4.
(3)实验室常用亚硫酸盐与HCl或H2SO4反应制备SO2,Na2SO3与盐酸反应的化学方程式为Na2SO3+2HCl═2NaCl+H2O+SO2↑.
(4)小鸿同学利用中和反应的原理,在空气中放置一段时间的酸雨(pH约为3)中加入足量的KOH,并就反应后混合溶液中盐的成分进行如下探究:
【提出猜想】反应后的混合溶液中盐的成分是什么?
猜想1:只有K2SO4
猜想2:只有K2SO3
猜想3:既有K2SO4,也有K2SO3
【实验探究】限选试剂:稀硫酸、稀盐酸、稀硝酸氯化钡溶液、澄清石灰水、红色品红溶液、紫色石蕊溶液.
| 步骤 | 实验操作 | 预期现象与结论 |
| 1 | 各取2mL反应后混合溶液分别加入A、B两支试管中 | / |
| 2 | 向A试管中滴加足量稀硫酸,随即滴加几滴红色品红溶液. | 有气泡产生,品红溶液褪色, 证明含有K2SO3. |
| 3 | 向B试管中,加入足量的氯化钡溶液,再加入足量稀盐酸. | 先有白色沉淀产生,后有气泡产生,沉淀部分溶解,证明含有K2SO4,则猜想3成立. |
18.在小组活动中,老师讲烘干的碳酸镁与锌粉按照一定比例研细混匀,按照图1进行实验.
【提出问题】碳酸镁与锌粉反应的产物是什么?
【查阅资料】①氧化镁、氧化锌:均为白色固体,均与盐酸反应,生成无色盐溶液.
②碳酸镁、碳酸锌:均为白色固体,均与盐酸反应,生成无色盐溶液和二氧化碳气体.
【实验探究】
(1)实验一:碳酸镁与锌粉反应的气体产物是什么?
结论:碳酸镁与锌粉反应的气体燃烧的化学方程式为2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2.

2)实验二:碳酸镁与锌粉反应的固体产物是什么?
老师将加热后的剩余固体分成两份,由甲、乙两组同学进行探究.
甲组同学将剩余固体直接按照图2进行实验,观察到A中有大量气泡生成,B中的澄清石灰水变浑浊,将产生的气体在C处验纯后点燃,观察到淡蓝色火焰.C处点燃的气体是H2(填化学式).甲组同学获得结论:该反应的固体产物是碳酸锌和镁.
乙组同学提出了质疑,他们先将另一份剩余固体先进行了处理,然后也按照图2进行了实验,观察到A中固体溶解,生成无色溶液,B中没有明显变化.他们对剩余固体的处理操作是继续按图1方式加热,直至不再产生气体.乙组同学利用实验现象,分析碳酸镁与锌粉反应的化学方程式为MgCO3+Zn$\frac{\underline{\;\;△\;\;}}{\;}$MgO+ZnO+CO↑.甲组同学对实验过程再次进行了认真分析,确定他们放入试管A中的固体含有MgCO3、Zn、MgO、ZnO.
【实验反思】:通过以上实验说明,在研究反应后的产物时.要考虑反应物是否有剩余.
【提出问题】碳酸镁与锌粉反应的产物是什么?
【查阅资料】①氧化镁、氧化锌:均为白色固体,均与盐酸反应,生成无色盐溶液.
②碳酸镁、碳酸锌:均为白色固体,均与盐酸反应,生成无色盐溶液和二氧化碳气体.
【实验探究】
(1)实验一:碳酸镁与锌粉反应的气体产物是什么?
| 序号 | 实验操作 | 实验现象 |
| ① | 收集两瓶气体,盖好玻璃片,停止加热,向其中一瓶迅速倒入少量澄清石灰水,盖好振荡. | 无明显现象. |
| ② | 将另一瓶气体点燃,待火焰熄灭后,迅速倒入少量澄清石灰水,盖好振荡. | 气体安静燃烧,火焰呈蓝色,澄清石灰水变浑浊. |

2)实验二:碳酸镁与锌粉反应的固体产物是什么?
老师将加热后的剩余固体分成两份,由甲、乙两组同学进行探究.
甲组同学将剩余固体直接按照图2进行实验,观察到A中有大量气泡生成,B中的澄清石灰水变浑浊,将产生的气体在C处验纯后点燃,观察到淡蓝色火焰.C处点燃的气体是H2(填化学式).甲组同学获得结论:该反应的固体产物是碳酸锌和镁.
乙组同学提出了质疑,他们先将另一份剩余固体先进行了处理,然后也按照图2进行了实验,观察到A中固体溶解,生成无色溶液,B中没有明显变化.他们对剩余固体的处理操作是继续按图1方式加热,直至不再产生气体.乙组同学利用实验现象,分析碳酸镁与锌粉反应的化学方程式为MgCO3+Zn$\frac{\underline{\;\;△\;\;}}{\;}$MgO+ZnO+CO↑.甲组同学对实验过程再次进行了认真分析,确定他们放入试管A中的固体含有MgCO3、Zn、MgO、ZnO.
【实验反思】:通过以上实验说明,在研究反应后的产物时.要考虑反应物是否有剩余.
 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至恰好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至恰好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算: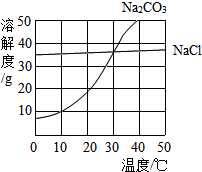 (1)30℃时,氯化钠的溶解度=碳酸钠的溶解度(填写“>”、“<”或“=”);
(1)30℃时,氯化钠的溶解度=碳酸钠的溶解度(填写“>”、“<”或“=”);