题目内容
10. 某纯碱中含有少量氯化钠杂质,为检验其纯度,小周取出27g纯碱样品,平均分成五份,依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应、待气体充分溢出后,用天平称质量(如图),得到如表数据.请计算
某纯碱中含有少量氯化钠杂质,为检验其纯度,小周取出27g纯碱样品,平均分成五份,依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应、待气体充分溢出后,用天平称质量(如图),得到如表数据.请计算| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入纯碱样品的质量/g | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
| 电子天平的示数/g | 163.2 | 166.4 | 169.6 | 173.9 | 179.3 |
(2)计算纯碱样品中碳酸钠的质量分数是多少?(精确到0.1%)
(3)关于所用稀盐酸的质量分数,三位同学做法各不相同(如图).判断谁的做法正确,并分析另两位同学的错误之处.

分析 (1)根据质量守恒定律,由反应前后烧杯及所盛物质总质量的差,计算生成二氧化碳的质量;
(2)根据完全反应后所放出二氧化碳的质量,计算样品中碳酸钠的质量,由碳酸钠质量与样品质量比计算样品中碳酸钠质量分数进行解答;
(3)根据完全反应后所放出二氧化碳的质量,计算所用稀盐酸的质量即可进行解答.
解答 解:.(1)根据质量守恒定律,第一次加入纯碱样品充分反应后,生成二氧化碳的质量为:100g+60g+5.4g-163.2g=2.2g;
(2)解:第一次反应产生CO2质量100g+60g+5.4g-163.2g=2.2g,
设消耗碳酸钠质量为m,
Na2CO3+2HCl=2NaCl+H2O+CO2(1分)
106 44
m 2.2g
$\frac{106}{m}$=$\frac{44}{2.2g}$
m=5.3g
碳酸钠的质量分数为:$\frac{5.3g}{5.4g}$100%=98.1%;
(3)明明的做法正确;
芳芳:反应掉HCl的质量计算正确,但所用稀盐酸质量不为20g(第4、五次盐酸已不足),也就是说盐酸的用量不是五次均分的,所以质量分数计算错误;
秀秀:5次实验并没有消耗样品中全部碳酸钠,所以不可用26.5g计算消耗的HCl的质量,因此结果错误.
故答案为:(1)2.2;
(2)98.1%;
(3)明明的做法正确;
芳芳:反应掉HCl的质量计算正确,但所用稀盐酸质量不为20g(第4、五次盐酸已不足),也就是说盐酸的用量不是五次均分的,所以质量分数计算错误;
秀秀:5次实验并没有消耗样品中全部碳酸钠,所以不可用26.5g计算消耗的HCl的质量,因此结果错误.
点评 根据第三次实验数据加入稀盐酸后剩余物质质量不再改变可知得,此时所加入的稀盐酸不再反应,碳酸钠完全反应,反应放出二氧化碳的总质量可由质量守恒定律求得.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案①烧碱 ②淀粉 ③蔗糖 ④甲烷 ⑤蛋白质 ⑥草木灰.
| A. | ①②③④⑤⑥ | B. | ②③④⑤ | C. | ③④⑤⑥ | D. | ①③④⑤ |
| A. | +4价 | B. | +5价 | C. | +6价 | D. | +7价 |
| A. | 该元素原子的质子数为57 | B. | 该元素原子的核电荷数为57 | ||
| C. | 该元素原子的相对原子质量为114 | D. | 该元素为非金属元素 |
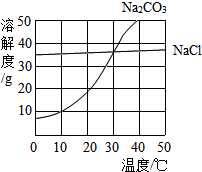 (1)30℃时,氯化钠的溶解度=碳酸钠的溶解度(填写“>”、“<”或“=”);
(1)30℃时,氯化钠的溶解度=碳酸钠的溶解度(填写“>”、“<”或“=”);

 为研究中和反应,某科学兴趣小组同学用稀H2SO4和NaOH溶液反应进行了实验.
为研究中和反应,某科学兴趣小组同学用稀H2SO4和NaOH溶液反应进行了实验.