题目内容
经过一年的化学学习,我们对“酸、碱、盐”有了一定的认识: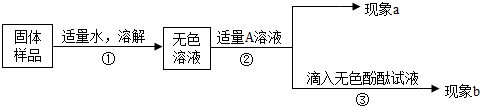
(1)氢氧化钙、氢氧化钠等常见的碱都有很多相似的化学性质,因为在它们的水溶液里都有相同的粒子 (填符号).
(2)工业上常选用氢氧化钙来中和酸性污水的原因是 (任答一条即可);炉具清洁剂中常含有氢氧化钠以清除油污,此过程属于 (填“物理”或“化学”)变化.
(3)氢氧化钙、氢氧化钠均需要密闭保存,请用方程式表示氢氧化钠密闭保存的原因 .
(4)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行如图实验.若A是Ba(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,该实验 (填“能”或“不能”)说明样品中有NaOH和Na2CO3,你的理由是 .
(5)取20g部分变质的氢氧化钠样品,加水配制成溶液,向上述溶液中加入足量的氢氧化钡溶液,生成沉淀为9.85g,计算该样品中所含杂质的质量分数(结果精确到0.1%).
(6)认识物质要一分为二.氢氧化钠能与许多非金属氧化物反应,请举出利用此原理服务于生活、生产的一个事例 .

(1)氢氧化钙、氢氧化钠等常见的碱都有很多相似的化学性质,因为在它们的水溶液里都有相同的粒子
(2)工业上常选用氢氧化钙来中和酸性污水的原因是
(3)氢氧化钙、氢氧化钠均需要密闭保存,请用方程式表示氢氧化钠密闭保存的原因
(4)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行如图实验.若A是Ba(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,该实验
(5)取20g部分变质的氢氧化钠样品,加水配制成溶液,向上述溶液中加入足量的氢氧化钡溶液,生成沉淀为9.85g,计算该样品中所含杂质的质量分数(结果精确到0.1%).
(6)认识物质要一分为二.氢氧化钠能与许多非金属氧化物反应,请举出利用此原理服务于生活、生产的一个事例
考点:碱的化学性质,盐的化学性质,根据化学反应方程式的计算
专题:常见的碱 碱的通性
分析:(1)理解碱的定义:碱是在水溶液中电离出的阴离子全部是氢氧离子的化合物.
(2)从性质和价格、环保等上分析用途;氢氧化钠以清除油污利用化学原理.
(3)氢氧化钠固体易吸水潮解,能与空气中的二氧化碳反应,据此解答.
(4)根据氢氧化钡与碳酸钠反应生成的氢氧化钠也会使酚酞试液变红分析.
(5)根据氢氧化钠的用途分析.
(2)从性质和价格、环保等上分析用途;氢氧化钠以清除油污利用化学原理.
(3)氢氧化钠固体易吸水潮解,能与空气中的二氧化碳反应,据此解答.
(4)根据氢氧化钡与碳酸钠反应生成的氢氧化钠也会使酚酞试液变红分析.
(5)根据氢氧化钠的用途分析.
解答:解:(1)因为碱是在水溶液中电离出的阴离子全部是氢氧离子的化合物,所以碱在水溶液中具有相同的OH-;
(2)氢氧化钙既有碱性并且价格低廉,氢氧化钙微溶于水,不会形成二次污染等工业上常选用氢氧化钙来中和酸性污水;氢氧化钠以清除油污利用化学原理.
(3)氢氧化钠固体易吸水潮解,能与空气中的二氧化碳反应而变质,所以实验室固体药品氢氧化钠必须密闭保存,方程式为:CO2+2NaOH=Na2CO3+H2O.
(4)氢氧化钡能与碳酸钠反应生成碳酸钡沉淀和氢氧化钠,生成的氢氧化钠能使酚酞试液变红,故不能确定原固体中是否含有氢氧化钠;
(5)解:该20g样品中含杂质Na2CO3的质量为x
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
106 197
x 9.85g
=
x=5.3g
该样品中Na2CO3的质量分数为:
×100%=26.5%
答:该样品中Na2CO3的质量分数是26.5%.
(6)用氢氧化钠溶液吸收工业排放的二氧化硫气体,以防止形成酸雨.
故答案为:(1)OH- (1分) (2)氢氧化钙价格低廉 或 氢氧化钙微溶于水,不会形成二次污染等合理即可(1分); 化学(1分);(3)CO2+2NaOH=Na2CO3+H2O(1分) (4)不能(1分),因为氢氧化钡与碳酸钠反应生成的氢氧化钠也会使酚酞试液变红,无法证明原物质中还含有氢氧化钠.(1分)
(5)解:该20g样品中含杂质Na2CO3的质量为x
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH…(1分)
106 197
x 9.85g
=
x=5.3g…(1分)
该样品中Na2CO3的质量分数为:
×100%=26.5%…(1分)
答:该样品中Na2CO3的质量分数是26.5%
(6)用氢氧化钠溶液吸收工业排放的二氧化硫气体,以防止形成酸雨(合理即可)(1分)
(2)氢氧化钙既有碱性并且价格低廉,氢氧化钙微溶于水,不会形成二次污染等工业上常选用氢氧化钙来中和酸性污水;氢氧化钠以清除油污利用化学原理.
(3)氢氧化钠固体易吸水潮解,能与空气中的二氧化碳反应而变质,所以实验室固体药品氢氧化钠必须密闭保存,方程式为:CO2+2NaOH=Na2CO3+H2O.
(4)氢氧化钡能与碳酸钠反应生成碳酸钡沉淀和氢氧化钠,生成的氢氧化钠能使酚酞试液变红,故不能确定原固体中是否含有氢氧化钠;
(5)解:该20g样品中含杂质Na2CO3的质量为x
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
106 197
x 9.85g
| 106 |
| x |
| 197 |
| 9.85g |
x=5.3g
该样品中Na2CO3的质量分数为:
| 5.3g |
| 20g |
答:该样品中Na2CO3的质量分数是26.5%.
(6)用氢氧化钠溶液吸收工业排放的二氧化硫气体,以防止形成酸雨.
故答案为:(1)OH- (1分) (2)氢氧化钙价格低廉 或 氢氧化钙微溶于水,不会形成二次污染等合理即可(1分); 化学(1分);(3)CO2+2NaOH=Na2CO3+H2O(1分) (4)不能(1分),因为氢氧化钡与碳酸钠反应生成的氢氧化钠也会使酚酞试液变红,无法证明原物质中还含有氢氧化钠.(1分)
(5)解:该20g样品中含杂质Na2CO3的质量为x
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH…(1分)
106 197
x 9.85g
| 106 |
| x |
| 197 |
| 9.85g |
x=5.3g…(1分)
该样品中Na2CO3的质量分数为:
| 5.3g |
| 20g |
答:该样品中Na2CO3的质量分数是26.5%
(6)用氢氧化钠溶液吸收工业排放的二氧化硫气体,以防止形成酸雨(合理即可)(1分)
点评:主要考查了碱的化学性质、保存相关的知识,培养学生的应用知识的能力.

练习册系列答案
相关题目
每年5月31日为世界无烟日,吸烟有害健康,烟气中一定含有的有毒气体是( )
| A、O2 |
| B、N2 |
| C、CO2 |
| D、CO |
 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.