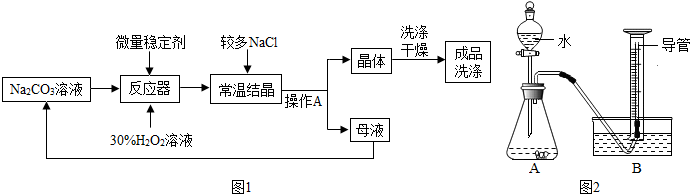
题目内容
选择合适的操作或仪器的序号填空:
①玻璃棒 ②试管 ③胶头滴管
④称量 ⑤过滤 ⑥搅拌
(1)溶解、过滤和蒸发都要使用的仪器是 ;
(2)吸取和滴加少量液体试剂的仪器 ;
(3)从析出晶体的硝酸钾饱和溶液中得到硝酸钾晶体的操作 ;
(4)配制100g 5%的氯化钠溶液的步骤是计算、 、溶解、装瓶贴标签.
①玻璃棒 ②试管 ③胶头滴管
④称量 ⑤过滤 ⑥搅拌
(1)溶解、过滤和蒸发都要使用的仪器是
(2)吸取和滴加少量液体试剂的仪器
(3)从析出晶体的硝酸钾饱和溶液中得到硝酸钾晶体的操作
(4)配制100g 5%的氯化钠溶液的步骤是计算、
考点:常用仪器的名称和选用,一定溶质质量分数的溶液的配制,结晶的原理、方法及其应用
专题:溶液、浊液与溶解度,常见仪器及化学实验基本操作
分析:化学仪器在做化学实验时经常用到,学会正确使用这些仪器的方法,是十分重要的.每种仪器,根据它的用途不同,有着不同的使用要求.各种化学仪器都有一定的使用范围.
解答:解:(1)溶解、过滤和蒸发都要使用的仪器是玻璃棒,但作用不同;
(2)胶头滴管可用于吸取和滴加少量液体试剂;
(3)过滤是将不溶性的固体和液体分离的方法,因此从析出晶体的硝酸钾饱和溶液中得到硝酸钾晶体的操作是过滤;
(4)配制100g 5%的氯化钠溶液的步骤是计算、称量、溶解、装瓶贴标签.
故答案为:(1)①;(2)③;(3)⑤;(4)④.
(2)胶头滴管可用于吸取和滴加少量液体试剂;
(3)过滤是将不溶性的固体和液体分离的方法,因此从析出晶体的硝酸钾饱和溶液中得到硝酸钾晶体的操作是过滤;
(4)配制100g 5%的氯化钠溶液的步骤是计算、称量、溶解、装瓶贴标签.
故答案为:(1)①;(2)③;(3)⑤;(4)④.
点评:化学是以实验为基础的学科,对于常见的仪器的名称、作用、使用注意事项等知识,同学们一定要了然于心.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案
相关题目
将燃料进行循环的构想为:燃料
燃烧产物
燃料,对上述两个转化过程表述正确的是( )
| ①燃烧 |
| ②太阳能或生物能 |
| A、①为物理变化②为化学变化 |
| B、①②均为物理变化 |
| C、①为化学变化②为物理变化 |
| D、①②均为化学变化 |
 儿童缺锌会引起食欲不振、发育不良.如图为某种补锌口服液说明书的一部分,请回答:
儿童缺锌会引起食欲不振、发育不良.如图为某种补锌口服液说明书的一部分,请回答:
 能源和环境与人类的生活和社会发展密切相关.
能源和环境与人类的生活和社会发展密切相关. A、B、C、D、E是初中常见的物质.它们的转化关系如图所示(部分物质已略去),其中A、B、C中均含有相同的金属元素,D、E是植物进行光合作用的物质.
A、B、C、D、E是初中常见的物质.它们的转化关系如图所示(部分物质已略去),其中A、B、C中均含有相同的金属元素,D、E是植物进行光合作用的物质.