题目内容
我国是铝生产大国,铝生产是以铝土矿为原料,经过纯制和电解过程生产而成,如图是生产铝的主要工艺流程及工艺介绍.
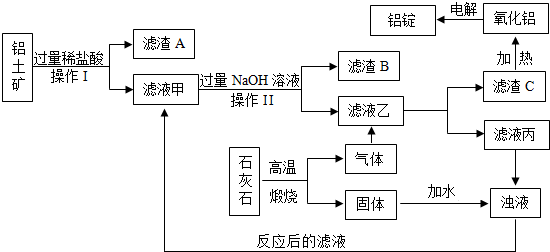
纯制工艺:就是先将铝土矿(主要成分是Al2O3,含有Fe2O3、MgCO3等杂质)分别用稀盐酸和氢氧化钠溶液溶解,去除杂质和获得偏铝酸钠溶液,然后向偏铝酸钠溶液中通入过量的CO2以便得到高纯度的Al(OH)3.电解工艺:通电分解由Al(OH)3加热分解而成的Al2O3.根据以上图解和介绍,请回答下列相关问题:
(1)生产流程中的操作II名称是 .
(2)铝土矿中加入过量稀盐酸会发生多个反应,其中的一个反应的化学方程式是 .
(3)滤液甲、滤液乙分别于NaOH和CO2反应的化学方程式是:
4NaOH+AlCl3=X(偏铝酸钠)+3NaCl+2H2O、2X+CO2+3H2O=2Al(OH)3↓+Na2CO3
这两个化学方程式中X的化学式为 .
(4)最终制得铝的化学方程式是 .
(5)为节约成本减少浪费整个生产流程中可进行循环使用的主要物质是 .

纯制工艺:就是先将铝土矿(主要成分是Al2O3,含有Fe2O3、MgCO3等杂质)分别用稀盐酸和氢氧化钠溶液溶解,去除杂质和获得偏铝酸钠溶液,然后向偏铝酸钠溶液中通入过量的CO2以便得到高纯度的Al(OH)3.电解工艺:通电分解由Al(OH)3加热分解而成的Al2O3.根据以上图解和介绍,请回答下列相关问题:
(1)生产流程中的操作II名称是
(2)铝土矿中加入过量稀盐酸会发生多个反应,其中的一个反应的化学方程式是
(3)滤液甲、滤液乙分别于NaOH和CO2反应的化学方程式是:
4NaOH+AlCl3=X(偏铝酸钠)+3NaCl+2H2O、2X+CO2+3H2O=2Al(OH)3↓+Na2CO3
这两个化学方程式中X的化学式为
(4)最终制得铝的化学方程式是
(5)为节约成本减少浪费整个生产流程中可进行循环使用的主要物质是
考点:物质的相互转化和制备,碳酸钙、生石灰、熟石灰之间的转化,酸的化学性质,碱的化学性质,质量守恒定律及其应用,书写化学方程式、文字表达式、电离方程式
专题:物质的制备
分析:(1)了解不溶物的分离方法.
(2)根据铝土矿(主要成分是Al2O3,含有Fe2O3、MgCO3等杂质),加入过量稀盐酸会发生多个反应,任意书写其中的一个反应的化学方程式.
(3)根据化学方程式和质量守恒定律,推测化学方程式中X的化学式.
(4)根据图可知,氧化铝点解最终制得铝,根据反应物、生成物、反应条件,书写化学方程式.
(5)根据整个生产流程,推测可进行循环使用的主要物质.
(2)根据铝土矿(主要成分是Al2O3,含有Fe2O3、MgCO3等杂质),加入过量稀盐酸会发生多个反应,任意书写其中的一个反应的化学方程式.
(3)根据化学方程式和质量守恒定律,推测化学方程式中X的化学式.
(4)根据图可知,氧化铝点解最终制得铝,根据反应物、生成物、反应条件,书写化学方程式.
(5)根据整个生产流程,推测可进行循环使用的主要物质.
解答:解:
(1)根据以上图解和介绍,则生产流程中的操作II名称是过滤.
(2)根据铝土矿(主要成分是Al2O3,含有Fe2O3、MgCO3等杂质),加入过量稀盐酸会发生多个反应,任意书写其中的一个反应的化学方程式,为 Al2O3+6HCl=2AlCl3+3H2O.
(3)根据“滤液甲、滤液乙分别于NaOH和CO2反应的化学方程式是:4NaOH+AlCl3=X(偏铝酸钠)+3NaCl+2H2O、2X+CO2+3H2O=2Al(OH)3↓+Na2CO3”和化学方程式,则这两个化学方程式中X的化学式为 NaAlO2.
(4)根据图可知,最终制得铝的化学方程式是 2Al2O3
4Al+3O2↑.
(5)为节约成本减少浪费整个生产流程中可进行循环使用的主要物质是NaOH、Na2CO3、Ca(OH)2
故答案为:
(1)过滤;
(2)Al2O3+6HCl=2AlCl3+3H2O.
(3)NaAlO2.
(4)2Al2O3
4Al+3O2↑.
(5)NaOH、Na2CO3、Ca(OH)2
(1)根据以上图解和介绍,则生产流程中的操作II名称是过滤.
(2)根据铝土矿(主要成分是Al2O3,含有Fe2O3、MgCO3等杂质),加入过量稀盐酸会发生多个反应,任意书写其中的一个反应的化学方程式,为 Al2O3+6HCl=2AlCl3+3H2O.
(3)根据“滤液甲、滤液乙分别于NaOH和CO2反应的化学方程式是:4NaOH+AlCl3=X(偏铝酸钠)+3NaCl+2H2O、2X+CO2+3H2O=2Al(OH)3↓+Na2CO3”和化学方程式,则这两个化学方程式中X的化学式为 NaAlO2.
(4)根据图可知,最终制得铝的化学方程式是 2Al2O3
| ||
(5)为节约成本减少浪费整个生产流程中可进行循环使用的主要物质是NaOH、Na2CO3、Ca(OH)2
故答案为:
(1)过滤;
(2)Al2O3+6HCl=2AlCl3+3H2O.
(3)NaAlO2.
(4)2Al2O3
| ||
(5)NaOH、Na2CO3、Ca(OH)2
点评:本题考查了铝土矿工业提纯氧化铝的流程分析和反应判断,掌握氧化铝、氢氧化铝性质是解题关键,题目难度中等.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
下列实验现象描述与事实不符合的是( )
| A、铁丝在氧气中燃烧,火星四射 |
| B、红磷在空气中燃烧,产生大量白烟 |
| C、镁与稀盐酸反应产生气体,放出热量 |
| D、木炭在氧气中燃烧,发出白光,有黑色固体生成 |