题目内容
10.某化学兴趣小组的同学在学习九年级《化学》下册中的资料卡片“石笋和钟乳石的形成”时,发现难溶于水的碳酸钙当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O═Ca(HCO3)2,联想到实验室中澄清石灰水与二氧化碳反应会生成碳酸钙:Ca(OH)2+CO2═CaCO3↓+H2O,对长时间向碱溶液中通入CO2反应后溶液中的溶质组成产生了浓度的兴趣.【提出问题】一定量CO2与NaOH溶液反应后的溶质组成是什么?
【查阅资料】(1)通入少量CO2反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O.
(2)通入过量CO2,反应的化学方程式为:Na2CO3+CO2+H2O═2NaHCO3.
(3)碳酸氢盐都是可溶于水的.BaCO3难溶于水.
(4)碳酸氢钠溶液呈碱性.
【提出猜想】(1)溶质为NaOH和Na2CO3;(2)溶质为Na2CO3;
(3)溶质为NaHCO3和Na2CO3(填化学式);(4)溶质为NaHCO3.
【设计实验】
| 实验步骤 | 实验现象 | 实验结论 |
| (1)用玻璃棒蘸取反应后溶液,滴在pH试纸上 | pH=9 | 该溶液显碱性 |
| (2)取反应后溶液少许于试管中,向其中滴加过量的BaCl2溶液 | 有 白色沉淀生成 | 猜想(4)不成立 |
| (3)取步骤(2)中的上层清液,滴入稀盐酸 | 有气泡冒出 | 猜想(1)和(2)不成立 |
【讨论交流】(1)有同学提出,实验步骤(1)是多余的.你认为该实验设计是否需要?不需要(填“需要”或“不需要”).
(2)同学们又一次把目光投向了教材,发现遇热或压强变小时:Ca(HCO3)2=CaCO3↓+CO2↑+H2O,纷纷提出,干粉灭火器中用NaHCO3灭火的反应原理与之相似,试写出NaHCO3受热分解的化学方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
【反思应用】(1)同学们回忆起实验室检验二氧化碳的情景,心想:如果向澄清石灰水中不断通入二氧化碳,会看到怎样的现象呢?请你描述一下:石灰水先变浑浊,后又变回澄清.
(2)老师投影图片-新化县的梅山龙宫,冷水江市的波月洞,涟源市的藏经阁,双峰县的药王洞…宛如人间仙境的美丽溶洞,竟然是文中两个简单的化学反应创造?!同学们不禁对大自然的鬼斧神工咋不决口,纷纷表示“娄底那么大,我想去看看”.
分析 【查阅资料】根据氢氧化钠的化学性质:氢氧化钠与二氧化碳反应生成碳酸钠和水,据此进行分析解答.
【提出猜想】根据氢氧化钠与二氧化碳反应原理进行猜想;
【设计实验】根据碳酸钠和氯化钡产生碳酸钡白色沉淀,碳酸氢钠与氯化钡不反应;碳酸氢钠和稀盐酸产生二氧化碳气体解答.
【讨论交流】(1)根据氢氧化钠、碳酸钠、碳酸氢钠溶液都为碱性解答;
(2)酸氢钠不稳定受热分解生成碳酸钠和二氧化碳、水.
(3)二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水,生成的碳酸钙继续与二氧化碳反应能生成碳酸氢钙,形成均一、稳定的混合物.
解答 解:
【查阅资料】CO2与NaOH溶液反应产生碳酸钠和水,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O.
【提出猜想】通入少量CO2反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O.通入过量CO2,反应的化学方程式为:Na2CO3+CO2+H2O═2NaHCO3.
(1)溶质为NaOH和Na2CO3;(2)溶质为Na2CO3;(3)溶质为2NaHCO3和Na2CO3;(4)溶质为NaHCO3.
【设计实验】
(1)用玻璃棒蘸取反应后溶液,滴在pH试纸上,pH=9,该溶液显碱性;
(2)取反应后溶液少许于试管中,向其中滴加过量的BaCl2溶液,碳酸钠和氯化钡产生碳酸钡白色沉淀,如果有白色沉淀生成,猜想(4)不成立;
(3)取步骤(2)中的上层清液,滴入稀盐酸,有气泡冒出,说明有碳酸氢钠,猜想(1)和(2)不成立;
【讨论交流】(1)氢氧化钠、碳酸钠、碳酸氢钠溶液都为碱性,故实验步骤(1)是多余的.不需要;
(2)NaHCO3不稳定,加热分解生成碳酸钠、水和二氧化碳气体,反应的方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(3)将少量二氧化碳通入足量的澄清石灰水中,生成的不溶于水的碳酸钙悬浮在液体中,通入过量二氧化碳后,碳酸钙、二氧化碳、水进行反应,生成溶于水的碳酸氢钙,形成了均一、稳定的混合物,属于溶液.
答案:
【查阅资料】CO2+2NaOH=Na2CO3+H2O.
【提出猜想】(3)NaOH和Na2CO3;
【设计实验】
| 实验步骤 | 实验现象 | 实验结论 |
| (1)用玻璃棒蘸取反应后溶液,滴在pH试纸上 | pH=9 | 该溶液显碱性 |
| (2)取反应后溶液少许于试管中,向其中滴加过量的BaCl2溶液 | 有 白色沉淀生成 | 猜想(4)不成立 |
| (3)取步骤(2)中的上层清液,滴入稀盐酸 | 有气泡冒出 | 猜想(1)和(2)不成立 |
(2)2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(3)石灰水先变浑浊,后又变回澄清.
点评 熟练掌握二氧化碳和氢氧化钠的化学性质,能够根据物质的性质设计实验对物质进行鉴别,在学习中要注意培养自己设计实验的能力.

 精英口算卡系列答案
精英口算卡系列答案| A. | 蜡烛熔化 | B. | 铁水铸锅 | C. | 纸张燃烧 | D. | 海水晒盐 |
| 物质 | 甲 | 乙 | 丙 | 丁 |  |
| 分子示意图 |  |  |  |  |
| A. | 甲物质属于有机物 | |
| B. | 该反应属于置换反应 | |
| C. | 反应后元素的种类不变 | |
| D. | 该反应的化学方程式为:C2H4+302 $\frac{\underline{\;点燃\;}}{\;}$2C02+2H20 |
 在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:
在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:小萌同学通过探究发现,此包装袋中的生石灰干燥剂已经完全变质失效.他采用的探究方法是:取少量样品于试管中,加入少量水,用手触摸试管外壁,没有明显的放热现象.此实验中加入的水必须是少量的,理由是如果所加的水较多,则水会吸收反应产生的热量,影响实验的结论.
【查阅资料】
石灰干燥剂的成分为CaO,请写出该干燥剂干燥原理CaO+H2O=Ca(OH)2(用化学方程式表示).
【提出猜想】①该干燥剂的成分为Ca(OH)2
②该干燥剂的成分为CaCO3
③你的猜想是CaCO3、Ca(OH)2;
【方案设计】小组成员设计了如下的实验方案:
方案一:取样滴加稀盐酸,有气泡产生,则白色固体只存在CaCO3;
方案二:取样滴加少量稀盐酸,没有气泡产生,则白色固体中只存在Ca(OH)2;
方案三:取样加入水中,振荡,静置,上层为清液,下层出现固体不溶物,取上层清液滴加酚酞试液,变红,则固体为CaCO3和Ca(OH)2的混合物.
【实验分析】小组成员经过讨论发现上述实验方案都存在着问题.
(1)上述方案一中存在的问题是不能说明白色固体中是否含有Ca(OH)2.
(2)上述方案二的结论是错误的,原因是由于加入的盐酸是少量的,可能只是与氢氧化钙发生了反应,还没有与碳酸钙反应,无法证明没有碳酸钙的存在.
(3)实验方案三中的结论也有些不妥,是因为不能说明白色固体中含有CaCO3,因为不溶物可能是微溶于水的氢氧化钙.
(4)实验证实,该固体是CaCO3和Ca(OH)2的混合物,请你再设计一种实验方案予以证明,只要写出实验步骤和现象即可.
| 实验操作步骤 | 实验现象 |
| (1)取样,滴加足量稀盐酸 (2)另取适量的样品,加足量的水溶解,静置取上层清液,滴加酚酞试液 | (1)产生大量的气泡 (2)溶液呈红色 |
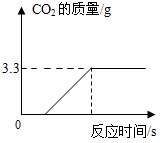
为了进一步确定该混合物中CaCO3的质量分数,实验小组的同学取了15克样品,加入足量的稀盐酸,实验测得生成CO2气体的质量如图所示,请据图计算该混合物中CaCO3的质量分数.
【反思与评价】
实验中造成计算结果与实际值相比偏小,则可能的原因是有部分生成的二氧化碳气体因溶解于水而没有全部逸出.
| A. | 可回收垃圾:易拉罐 | B. | 不可回收垃圾:废报纸 | ||
| C. | 有害垃圾:废旧电池 | D. | 餐厨垃圾:剩余饭菜 |
| A. | H2 | B. | O2 | C. | H2O2 | D. | H2SbO4 |
| A. | NaCl 氯化钠 食盐 | B. | CaO 氧化钙 熟石灰 | ||
| C. | Na2CO3 碳酸钠 纯碱 | D. | NaOH 氢氧化钠 烧碱 |
| A. | 腌制的泡菜虽然富含亚硝酸盐,但多吃无妨 | |
| B. | 焊接金属时用氧气做保护气 | |
| C. | 铵态氮肥与熟石灰混合使用可以明显提高肥效 | |
| D. | 回收各种废弃塑料,能有效解决“白色污染”问题 |
 .
.