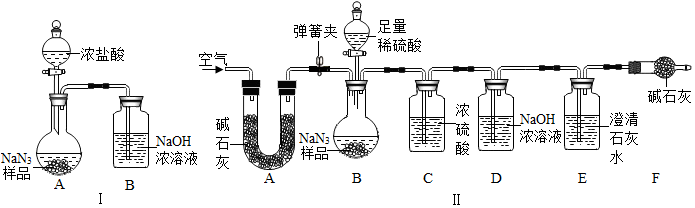
题目内容
17.下列各组物质的名称、俗称、化学式均表示同一种物质的是( )| A. | 硫酸铜晶体,胆矾,CuSO4•5H2O | B. | 氯化钠,苏打,NaCl | ||
| C. | 氢氧化钠,纯碱,NaOH | D. | 碳酸钙,生石灰,Ca(OH)2 |
分析 根据常见化学物质的名称、俗称、化学式进行分析判断即可.
解答 解:A.硫酸铜晶体俗称蓝矾、胆矾,其化学式为CuSO4•5H2O,故正确;
B.氯化钠俗称食盐,苏打是碳酸钠的俗称,故错误;
C.氢氧化钠俗称火碱、烧碱、苛性钠,纯碱是碳酸钠的俗称,故错误;
D.碳酸钙是石灰石或大理石的主要成分,其化学式为CaCO3;生石灰是氧化钙的俗称,其化学式为CaO;Ca(OH)2是氢氧化钙的化学式,俗称熟石灰、消石灰,故错误.
故选A.
点评 本题难度不大,熟练掌握常见化学物质的名称、俗称、化学式是正确解答此类题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
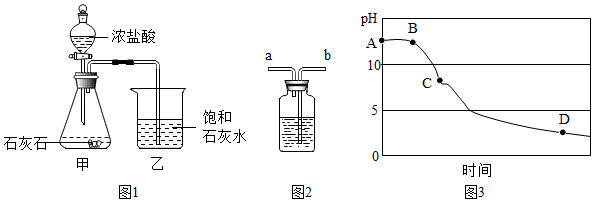
2.在制取CO2的实验中,小科发现质量相同而粗细不同的大理石与盐酸反应,CO2的产生速度细的比粗的快得多.经思考后,小科设计了如下实验(每次实验均用1g大理石,20mL盐酸)
(1)为了比较反应速度,设计如图一所示装置,其中量筒的作用是通过观察单位时间内排入量筒中水的体积来判断反应速率;
(2)实验中CO2体积随时间的变化关系如图二所示,请将实验2中CO2体积随时间变化的曲线画在图二中.
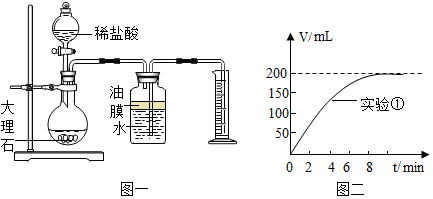
(3)已知20℃该气压下CO2气体密度约1.98g/L,求大理石中CaCO3的质量分数?(详细计算过程)(C-12 O-16 Ca-40)
| 实验序号 | 温度(℃) | 大理石颗粒 | 盐酸质量分数(%) | 实验目的 |
| 1 | 20 | 粗 | 5 | 探究大理石和盐酸的反应速度与石灰石颗粒大小的关系 |
| 2 | 20 | 细 | 5 |
(2)实验中CO2体积随时间的变化关系如图二所示,请将实验2中CO2体积随时间变化的曲线画在图二中.

(3)已知20℃该气压下CO2气体密度约1.98g/L,求大理石中CaCO3的质量分数?(详细计算过程)(C-12 O-16 Ca-40)
9.某化学兴趣小组的同学利用如图装置制取收集一瓶二氧化碳气体,请和他们一起完 成以下实验探究.
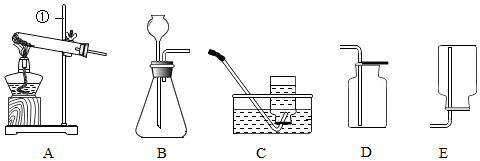
(1)写出标号①的仪器名称__________.
(2)实验室制取一瓶二氧化碳气体,应选用的收集装置为D(填序号),反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)化学兴趣小组的同学对反应后废液中溶质的成分进行进一步探究.
【提出问题】废液中的溶质含有哪些物质?
【查阅资料】氯化钙溶液呈中性.
【猜想与假设】猜想①:废液中的溶质只有氯化钙; 猜想②:废液中的溶质是氯化钙和HCl(填化学式).
【设计并进行实验】
I.为验证上面两种猜想哪种正确,甲小组的同学从下面A~E五种药品中选择合适的一种进行实验,证明了猜想②是正确的.他们选择的药品不可能是
BE.A.紫色石蕊试液 B.无色酚酞试液 C.锌粒 D.氧化铁粉末 E.氢氧化钠溶液
Ⅱ.乙小组用一种钠盐溶液进行实验,也证明了猜想②是正确的,请完成下面的实验报告.
【探究反思】:实验产生的污染深受人们重视,我们要利用恰当的方法对废液进行处理,实行无害化排放,从源头上消除对环境的污染.

(1)写出标号①的仪器名称__________.
(2)实验室制取一瓶二氧化碳气体,应选用的收集装置为D(填序号),反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)化学兴趣小组的同学对反应后废液中溶质的成分进行进一步探究.
【提出问题】废液中的溶质含有哪些物质?
【查阅资料】氯化钙溶液呈中性.
【猜想与假设】猜想①:废液中的溶质只有氯化钙; 猜想②:废液中的溶质是氯化钙和HCl(填化学式).
【设计并进行实验】
I.为验证上面两种猜想哪种正确,甲小组的同学从下面A~E五种药品中选择合适的一种进行实验,证明了猜想②是正确的.他们选择的药品不可能是
BE.A.紫色石蕊试液 B.无色酚酞试液 C.锌粒 D.氧化铁粉末 E.氢氧化钠溶液
Ⅱ.乙小组用一种钠盐溶液进行实验,也证明了猜想②是正确的,请完成下面的实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| 取少量反应后的废液于试管中,加入足量Na2CO3(填化学式)溶液,振荡. | 大量气泡 | 猜想②正确 |
6.NH3和Cl2混合可发生下列化学反应:2NH3+3Cl2=6HCl+N2,该反应的基本类型是( )
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |