题目内容
17.图1是实验室制取氧气或二氧化碳时经常用到的仪器,请回答有关问题.
(1)写出编号仪器名称:④试管;⑧长颈漏斗.
(2)当实验室制取较多量CO2时,发生装置的仪器组合是②⑦⑧(填标号).实验室制取二氧化碳的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
检验二氧化碳的原理是CO2+Ca(OH)2=CaCO3↓+H2O(用化学方程式表示).
(3)某同学用软塑料瓶自制气体发生装置,通过捏放瓶身可随时控制反应发生和停止(如图2).若利用该装置制氧气,反应的化学方程式为2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.若利用该装置制二氧化碳,无纺布包内药品为大理石或石灰石(写名称).

(4)阅读材料回答问题.
资料:
1、氨气是有刺激性气味的无色气体,密度比空气小,极易溶于水.
2、加热熟石灰和氯化铵的固体混合物可生成氨气.
3、湿润的红色石蕊试纸遇到氨气变蓝色;氨气遇到浓盐酸时冒白烟(生成NH4Cl固体).
I.制取氨气的发生装置与实验室用高锰酸钾(填“高锰酸钾”或“双氧水”)制氧气的装置相同,因此图5中还缺少的仪器是酒精灯(填仪器名称).
II.若用图3装置收集氨气,进气口应为b端(选填“a”或“b”),检验氨气集满的方法是将湿润的红色石蕊试纸放在a管口,若变蓝则已满.
分析 (1)熟记仪器的名称;
(2)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;结合二氧化碳能使澄清的石灰水变浑浊来检验;
(3)根据制取氧气的原理以及实验室中制取二氧化碳的药品来分析;
(4)根据实验室制取氨气的反应物是固体,反应条件是加热进行分析;
根据密度比空气小,极易溶于水,其水溶液显碱性进行分析.
解答 解:(1)④是试管,⑧是长颈漏斗;故填:试管;长颈漏斗;
(2)实验室用大理石和稀盐酸反应制取较多量CO2时,发生装置需要体积较大的锥形瓶作为反应容器⑦,需要带导管的双孔橡皮塞②和加入液体药品需要的长颈漏斗⑧;反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;检验二氧化碳气体用澄清的石灰水,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O.故填:②⑦⑧;CaCO3+2HCl═CaCl2+H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O;
(3)该装置适用于固液常温下制取气体,若制取氧气则为过氧化氢在二氧化锰的催化作用下能生成水和氧气,若是制取二氧化碳,则使用的固体药品是石灰石或大理石,故填:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;大理石或石灰石;
(4)I、制取氨气的装置与实验室用高锰酸钾制氧气的装置相同,这是因为反应物都是固体,都需要加热;还缺少的仪器名称是酒精灯,酒精灯用作热源;
II、若用如图2装置收集氨气,因为氨气的密度比空气小,所以进气口应为b;检验氨气集满的方法是:将湿润的红色石蕊试纸放在a管口,若变蓝则已满.
故填:I、高锰酸钾;酒精灯;
II、b;将湿润的红色石蕊试纸放在a管口,若变蓝则已满.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

| A. |  毛白菜 毛白菜 | B. |  菜籽油 菜籽油 | C. |  白丝鱼 白丝鱼 | D. |  丝苗米饭 丝苗米饭 |
 化学兴趣小组的同学在实验室发现一瓶保管不当,盛有无色溶液的试剂瓶,且标签破损(如图),其残缺的标签中只剩下“Na”字样.老师告诉他们,这瓶溶液中的溶质可能是氢氧化钠、氯化钠或碳酸钠.同学们很感兴趣,决定对其成分进行探究.
化学兴趣小组的同学在实验室发现一瓶保管不当,盛有无色溶液的试剂瓶,且标签破损(如图),其残缺的标签中只剩下“Na”字样.老师告诉他们,这瓶溶液中的溶质可能是氢氧化钠、氯化钠或碳酸钠.同学们很感兴趣,决定对其成分进行探究.【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是A(填字母).
A.酸 B.碱 C.盐
【查阅资料】碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应.
【作出猜想】(1)可能是NaOH溶液;(2)可能是Na2CO3溶液;(3)可能是NaCl溶液.
【设计并实验】
| 实验 | 实验操作 | 主要实验现象 | 实验结论和解释 |
| Ⅰ | 取样于试管中,向其中滴加几滴无色酚酞溶液. | 无色溶液变红色 | 该溶液不可能是NaCl溶液.理由是 NaCl溶液呈中性,不能使酚酞变色. |
| Ⅱ | 另取样于另一支试管中,向其中滴加足量的稀盐酸. | 产生大量的气泡 | 该溶液中为碳酸钠.反应方程式 Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
老师指出该结论不严密.理由是:氢氧化钠溶液在空气中敞开放置,发生变质,能产生与实验Ⅰ和Ⅱ相同现象.请写出氢氧化钠溶液在空气中变质的化学反应方程式2NaOH+CO2═Na2CO3+H2O.
 表格和图象能直观反应物质的变化规律.请根据下列表格和图象,回答有关问题:
表格和图象能直观反应物质的变化规律.请根据下列表格和图象,回答有关问题:甲:氯化钠和氯化铵在不同温度时的溶解度
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| NH4Cl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
| NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
(2)镁与稀硫酸反应是放热反应.如乙图中从0到时间T产生氢气的速度逐渐增大,原因是镁与稀硫酸反应放热,加快反应速率,时间T后反应速度逐渐减小,逐渐减小的原因是随着反应的进行,稀硫酸浓度越来越低,反应越来越慢.
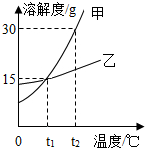 如图为甲、乙两种物质的溶解度取消,下列说法正确的是( )
如图为甲、乙两种物质的溶解度取消,下列说法正确的是( )| A. | 甲、乙两种物质的溶解度都不相等 | |
| B. | t1时,将两种饱和溶液升温至t2,溶液中溶质的质量分数都增大 | |
| C. | t1时,甲、乙两种物质的饱和溶液中,溶质质量分数均为15% | |
| D. | 将接近饱和的甲溶液变为饱和溶液,可采用蒸发或降温的方法 |


