题目内容
4.盐的应用在生产活动具有重要的地位和作用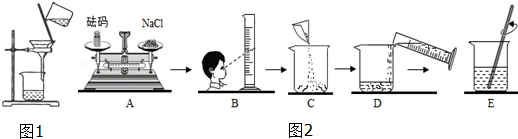
(1)海水晒盐是通过蒸发溶剂(填“蒸发溶剂”或“冷却热的饱和溶液”)的方法获得粗盐.
(2)粗盐中常含有不溶性杂质而需要提纯.实验室常用如图1所示装置进行粗盐提纯,该提纯的方法是过滤,其中玻璃棒的作用是引流.
(3)为检验提纯后所得氯化钠固体中是否含有可溶性杂质氯化镁,小明取少许固体,配制成溶液,滴入氢氧化钠溶液,观察到有白色沉淀产生,他推断含有氯化镁.试写出反应的化学方程式2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
(4)小强同学按如图2所示步骤依次操作配制15%的氯化钠溶液50g.
①图2中操作错误的步骤是AB(填字母),若图2A中砝码的质量为7g,游码为0.5g,则小明称得的氯化钠质量实际为6.5g;
②图2中的错误操作纠正后,所配制氯化钠溶液的溶质质量分数仍然偏小,其原因可能有ABD.
A.氯化钠固体不纯
B.称量时,砝码端忘垫质量相同的纸片
C.装瓶时,有少量溶液洒出
D.称好的氯化钠倒入烧杯时有少量洒出.
分析 (1)根据氯化钠的溶解度受温度变化的影响不大进行分析;
(2)根据除去粗盐中的不溶性杂质常用过滤,玻璃棒在过滤操作中的作用是引流进行分析;
(3)根据氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠进行分析;
(4)①根据量筒的正确使用方法,以及天平的正确使用方法进行分析;
②根据配制氯化钠溶液的溶质质量分数仍然偏小,可能是氯化钠少了,或者水多了进行分析.
解答 解:(1)氯化钠的溶解度受温度变化的影响不大,所以海水晒盐是通过蒸发溶剂的方法获得粗盐;
(2)除去粗盐中的不溶性杂质常用过滤,玻璃棒在过滤操作中的作用是引流;
(3)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,化学方程式为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(4)①天平称量物体质量应该是左物右码,量筒的正确使用方法是读数时,视线与凹液面的最低处保持水平,所以操作错误的步骤是AB,图2A中砝码的质量为7g,游码为0.5g,则小明称得的氯化钠质量实际为7g-0.5g=6.5g;
②A、氯化钠固体不纯,导致氯化钠质量偏小,溶质质量分数偏小,故A正确;
B、称量时,砝码端忘垫质量相同的纸片,导致氯化钠质量偏小,溶质质量分数偏小,故B正确;
C、装瓶时,有少量溶液洒出,不会影响溶质质量分数,故C错误
D、称好的氯化钠倒入烧杯时有少量洒出,导致氯化钠质量偏小,溶质质量分数偏小,故D正确.
故选:ABD.
故答案为:(1)蒸发溶剂;
(2)过滤,引流;
(3)2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(4)①AB,6.5;
②ABD.
点评 本题难度不大,明确配制一定溶质质量分数的溶液实验步骤、所需仪器、注意事项是正确解答本题的关键.

练习册系列答案
相关题目
14.某校化学兴趣小组同学在实验室整理药品时,发现盛装氢氧化钠溶液的试剂瓶未塞瓶塞,且试剂瓶口周围有一些白色固体,他们怀疑氢氧化钠已经变质,于是他进行了如下实验探究.
【提出问题】氢氧化钠溶液是否变质?
【查阅资料】氯化钠溶液、氯化钡溶液呈中性.
【实验探究】小王、小李两同学分别设计了不同方案并加以实验.
(1)因为氢氧化钠在空气中要吸收水而发生潮解,吸收二氧化碳而变质,所以应密闭保存. 其变质的反应方程式为2NaOH+CO2═Na2CO3+H2O.
(2)小李同学认为小王同学的结论不科学,其理由是:碳酸钠溶液显碱性,溶液的pH>7.
(3)小李同学的实验中观察到实验现象A为:有白色沉淀产生.
(4)小张同学认为该氢氧化钠溶液只是部分变质.为确定小张同学的猜想,应该对小李同学的实验进行如下改进:向试管中加入过量的氯化钡溶液,再向试管中滴加酚酞溶液,通过观察溶液颜色变化来检验该溶液是否含有氢氧化钠.如果只是部分变质,观察到的现象是:先有白色沉淀产生,后来酚酞变成红色.
(5)若要除去上述变质的氢氧化钠溶液中的杂质应加入适量的Ca(OH)2(填化学式)溶液而除去.
【提出问题】氢氧化钠溶液是否变质?
【查阅资料】氯化钠溶液、氯化钡溶液呈中性.
【实验探究】小王、小李两同学分别设计了不同方案并加以实验.
| 实 验 步 骤 | 实 验 现 象 | 结 论 | |
| 小王 | 用pH试纸测溶液的pH | 溶液的pH>7 | 说明氢氧化钠溶液没有变质 |
| 小李 | 取少量溶液于试管中,加入适量氯化钡溶液 | A | 说明氢氧化钠溶液已经变质 |
(2)小李同学认为小王同学的结论不科学,其理由是:碳酸钠溶液显碱性,溶液的pH>7.
(3)小李同学的实验中观察到实验现象A为:有白色沉淀产生.
(4)小张同学认为该氢氧化钠溶液只是部分变质.为确定小张同学的猜想,应该对小李同学的实验进行如下改进:向试管中加入过量的氯化钡溶液,再向试管中滴加酚酞溶液,通过观察溶液颜色变化来检验该溶液是否含有氢氧化钠.如果只是部分变质,观察到的现象是:先有白色沉淀产生,后来酚酞变成红色.
(5)若要除去上述变质的氢氧化钠溶液中的杂质应加入适量的Ca(OH)2(填化学式)溶液而除去.
12.下列关于甲烷(CH4)说法正确的是( )
| A. | 甲烷是一种有机物 | |
| B. | 甲烷是由碳和氢气组成的 | |
| C. | 甲烷是由一个碳原子和四个氢原子构成的 | |
| D. | 甲烷在氧气中燃烧只生成二氧化碳 |
19.类推是常用的思维方法.以下类推正确的是( )
| A. | 分子可以构成物质,所以物质一定由分子构成 | |
| B. | 燃烧一定会发光放热,所以发光放热的变化一定是燃烧 | |
| C. | 催化剂能改变物质的化学反应速率,所以能改变物质的化学反应速率的一定是催化剂 | |
| D. | 氧化反应是物质与氧发生的反应,所以物质与氧气发生的反应一定是氧化反应 |
16.长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体.甲、乙两位同学发现往水中投入过氧化钙时产生气泡.
(1)提出问题:当把过氧化钙投入足量水中时,最终会生成什么物质呢?
(2)进行猜想:甲同学认为:生成氧化钙和氧气;
乙同学认为:生成氢氧化钙[Ca(OH)2]和氧气.
你认为甲同学的猜想是错误的,其理由是氧化钙能与水反应生成氢氧化钙,最终产物不可能是氧化钙.
(3)设计实验:验证另一个同学的猜想是正确的,并填入下表空格中.
(1)提出问题:当把过氧化钙投入足量水中时,最终会生成什么物质呢?
(2)进行猜想:甲同学认为:生成氧化钙和氧气;
乙同学认为:生成氢氧化钙[Ca(OH)2]和氧气.
你认为甲同学的猜想是错误的,其理由是氧化钙能与水反应生成氢氧化钙,最终产物不可能是氧化钙.
(3)设计实验:验证另一个同学的猜想是正确的,并填入下表空格中.
| 实验方法 | 实验现象 | 实验结论 |
| 取少量过氧化钙放入试管中,加足量水,将带火星的木条伸进试管中. | ①木条复燃 | 有氧气生成 |
| 取实验静置后的上层清夜,②通入二氧化碳气体. | ③出现浑浊 | ④有氢氧化钙生成 |
13.下列各组溶液,不用其他试剂无法鉴别的是( )
| A. | H2SO4 NaCl Na2CO3 CaCl2 | B. | HCl NaOH CuSO4 MgSO4 | ||
| C. | Na2CO3 K2SO4 BaCl2 HCl | D. | NaNO3 HCl CaCl2 KOH |
14.下列发生物理变化的是( )
| A. | 鲜牛奶变质 | B. | 石灰水表面出现一层白膜 | ||
| C. | 稀有气体通电发光 | D. | 动植物呼吸 |

