题目内容
3.某制碱厂以海水为主要原料生产纯碱(碳酸钠)和其他副产品.I.将海水进行处理后获得精盐水.海水中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质.将杂质转化为沉淀过滤除去,在向滤液中加入适量的盐酸得到精盐水,该工艺示意如图1:

(1)对该过程的认识中,不正确的是AC
A.操作①中需要进行搅拌,目的是提高氯化钠的溶解度
B.操作③、④两步顺序可以颠倒
C.操作⑤得到的沉淀中有三种成分的物质
D.操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7
(2)加入碳酸钠溶液的目的是除去氯化钙和过量的氯化钡.
II.将精盐水制成饱和溶液,先向其中通入足量的氨气,在向其中通入足量的二氧化碳至有大量晶体(碳酸氢钠,NaHCO3)析出,反应的化学方程式为:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓:将晶体转移出来后,加热至不在有气体产生,所得固体即为纯碱.
(3)加热晶体碳酸氢钠获得纯碱的化学方程式为2NaHCO$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(4)制碱过程中获得的副产品可做化肥,其化学式为NH4Cl.
组成确定
(5)①称取一定质量的纯碱样品,经多次充分加热后,在称重,质量无变化:②另取少量纯碱样品加入适量水,样品完全溶液,向该溶液中加入过量稀HNO3,在滴加AgNO3溶液,有白色沉淀.由上述实验可确定纯碱样品含有杂质NaCl(化学式).
含量确定
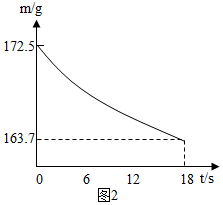
(6)称取纯碱样品21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图2所示.请通过计算并结合下表判断此纯碱样品等级为合格品.
| 工业纯碱标准:(Na2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
(7)某同学认为,在上述纯碱含量测定过程中,如果测得结果比实际纯度高,可能原因是稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大.
分析 (1)根据除去硫酸根离子用钡离子沉淀,除去镁离子用氢氧根离子进行沉淀,除去钙离子用碳酸根离子进行沉淀,过量的钡离子需要用碳酸根离子除去进行分析,再向滤液中加入适量的盐酸得到精盐水进行分析;
(2)根据碳酸钠和氯化钡反应会生成碳酸钡沉淀和氯化钠,和氯化钙反应会生成碳酸钙沉淀和氯化钠进行分析;
(3)根据碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳进行分析;
(4)根据氨碱法制纯碱的原理进行分析;
(5)根据确定纯碱样品含有的杂质,可用反向思维方法,先确定白色沉淀,再推断杂质是什么进行分析;
(6)利用质量守恒定律计算出二氧化碳的质量,再根据化学方程式计算出碳酸钠的质量分数,确定其等级;
(7)根据盐酸具有挥发性分析回答.
解答 解:(1)A、一定温度下,氯化钠的溶解度是固定不变的,不会因搅拌就改变其溶解度,只会加快氯化钠的溶解速度;故A错误;
B、③④两步颠倒不会影响除掉钡离子和镁离子而形成沉淀;故B正确;
C、加入过量的氯化钡溶液,可以将硫酸根离子转化为沉淀,加过量碳酸钠溶液,可以将钙离子和反应剩余的钡离子转化为沉淀,加过量氢氧化钠溶液,可以将镁离子转化为沉淀,所以⑤操作中得到的沉淀共有四种;故C错误;
D、⑥操作中,加入适量盐酸的目的是除去过量的氢氧化钠和碳酸钠从而得到氯化钠溶液呈中性;故D正确.
故选:AC;
(2)碳酸钠和氯化钡反应会生成碳酸钡沉淀和氯化钠,和氯化钙反应会生成碳酸钙沉淀和氯化钠,所以加入碳酸钠溶液的目的是:除去氯化钙和过量的氯化钡;
(3)碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:2NaHCO$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(4)根据氨碱法制纯碱的原理:NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl 副产物为:NH4Cl;
(5)由题意可知,滴加AgNO3溶液,有白色沉淀,此沉淀即AgCl,所以反应物中一定有氯离子,并且样品完全溶于水,由此可以推断纯碱样品含有杂质NaCl;
(6)从坐标读出烧杯总质量的变化为:172.5-163.7=8.8g 是生成二氧化碳的质量.
设产生8.8克二氧化碳需碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 8.8g
$\frac{106}{x}$=$\frac{44}{8.8g}$
x=21.2g
Na2CO3%=$\frac{21.2g}{21.5g}$×100%=98.6%
因:98.0%<98.6%<98.8%
所以此样品为合格品;
(7)稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大(或水蒸气随CO2气体排出,从而导致所测纯度偏大).
故答案为:(1)AC;
(2)除去氯化钙和过量的氯化钡;
(3)2NaHCO$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(4):NH4Cl;
(5)NaCl;
(6)合格;
(7)稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大.
点评 本题难度较大,主要考查了物质的分离操作和除去杂质的方法,要根据物质的性质选择适当的方法进行解答,培养学生对知识的应用和理解的能力;在书写化学方程式及计算过程一定要规范.

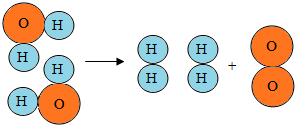
| A. | 这是一个化合反应 | |
| B. | 在化学变化中氢原子和氧原子是最小的粒子 | |
| C. | 水是由氢气和氧气组成的 | |
| D. | 在化学变化中氢分子和氧分子都没有发生变化 |
| A. | 氧气具有可燃性 | B. | 空气中含量最多的是氧气 | ||
| C. | 夏天食物腐烂与氧气无关 | D. | 通常用带火星的木条检验氧气 |
| A. |  果粒橙 | B. |  雪碧 | C. |  可口可乐 | D. |  矿泉水 |