题目内容
14.建立宏观、微观和符号之间的相互联系是化学学科的特点.(1)图1表示水、二氧化碳和氧气的循环图.

①从宏观角度看,图1中三种物质的组成中都含有氧元素,.
从微观角度看,图1中三种物质都是由分子构成的,硫酸铜是由铜离子和硫酸根离子构成(填具体微粒).
②试写出图1中实现b转化的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
(2)图2表示某反应的微观示意图.试写出相应的化学方程式Cl2+H2O═HCl+HClO.
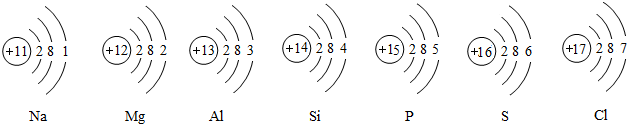
(3)图3表示氯和溴元素(Br)的原子结构示意图,由图可知,氯和溴具有相似化学性质的原因是原子的最外层电子数相同.
(4)A、B、C、D表示四种物质,其微观示意图如下所示:

①从微观角度看,B图表示:NH3(填化学符号)
②从宏观角度看,图中表示混合物的是C、D(填字母符号)
在一定的条件下,A和B能发生化学反应生成E和F,其微观示意图如下所示:

③若F为空气中体积分数最大的气体,则该反应中生成的E和F的质量比27:14.
④若F为氧化物,且A和B的分子个数比为5:4,则该反应的化学方程式为4NH3+5O2$\frac{\underline{\;一定条件下\;}}{\;}$4NO+6H2O.
分析 (1)①根据物质是由元素组成的解答;根据水、二氧化碳和氧气都是由分子构成的解答;
②根据电解水生成氢气和氧气;
(2)根据质量守恒定律可以正确书写化学方程式.
(3)在原子中,电子层数等于周期数,最外层电子数决定了元素性质.
(4)利用图示中有关的物质的分子结构的知识对微粒的个数以及对分子的结构进行分析;结合混合物含有多种分子,纯净物中含有一种分子分析解答.
①根据反应的微观示意图、空气的成分,分析反应物、生成物,写出反应的方程式,根据方程式进行计算.
②根据反应的微观示意图和质量守恒定律分析反应的反应物、生成物,写出反应的化学方程式.
解答 解:(1)①从宏观角度看,水、二氧化碳和氧气中三种物质的组成中都含有氧元素,
从微观角度看,水、二氧化碳和氧气中三种物质都是由分子构成的.硫酸铜是由铜离子和硫酸根离子构成.
②电解水的化学方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
(2)由图中可知,一个氯气分子和一个水分子反应生成一个氯化氢分子和一个次氯酸分子.化学方程式为:Cl2+H2O═HCl+HClO;
(3)图3表示氯和溴元素(Br)的原子结构示意图,由图可知,溴原子的核外有四个电子层,该元素周期表中位于第四周期,氯和溴具有相似化学性质是因为原子的最外层电子数相同.
(4)由图示的情况可知:A中含有3个氧气的分子,B中含有的是3个氨气分子(NH3);由于C中含有2个水分子和2个氧气分子、D含有3个氮气分子和1个氢气分子1个氧气分子,所以C、D均是混合物.
由题意可知,在一定条件下,A和B能发生化学反应生成E和F,若F为空气中体积分数最大的气体,应为氮气,由反应的微观示意图可知,该反应是氨气和氧气在一定条件下反应生成水和氮气,方程式为:4NH3+3O2$\frac{\underline{\;一定条件\;}}{\;}$6H2O+2N2,所以,E和F的质量比为:【6×(1×2+16)】:(2×14×2)=27:14.
②若F为氧化物,且A和B的分子个数比为5:4,由质量守恒定律反应前后原子的种类及数目不变可知,该反应生成了水和一氧化氮,反应的方程式是:4NH3+5O2$\frac{\underline{\;一定条件下\;}}{\;}$4NO+6H2O.
故答案为:
(1)①氧元素;分子;铜离子和硫酸根离子; ②2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑
(2)Cl2+H2O═HCl+HClO;
(3)原子的最外层电子数相同.
(4)①NH3;②C、D;
①27:14;②4NH3+5O2$\frac{\underline{\;一定条件下\;}}{\;}$4NO+6H2O.
点评 本题的难度不大,能够从宏观和微粒两个方面正确认识物质是解答本题的基础知识.

 特高级教师点拨系列答案
特高级教师点拨系列答案| A. | 剩余固体是混合物 | B. | 生成CO2的质量是20g | ||
| C. | 剩余固体的质量是42g | D. | 原混合物中CaCO3的质量是30g |
| A. | 提出假设 | B. | 设计实验 | C. | 收集证据 | D. | 作出结论 |
| A. | 物质可以由分子或原子等粒子直接构成,但分子一定是由原子构成的 | |
| B. | 原子、分子总在不断地运动 | |
| C. | 分子可以再分,原子不能再分 | |
| D. | 分子间有一定的间隔 |
I.将海水进行处理后获得精盐水.海水中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质.将杂质转化为沉淀过滤除去,在向滤液中加入适量的盐酸得到精盐水,该工艺示意如图1:

(1)对该过程的认识中,不正确的是AC
A.操作①中需要进行搅拌,目的是提高氯化钠的溶解度
B.操作③、④两步顺序可以颠倒
C.操作⑤得到的沉淀中有三种成分的物质
D.操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7
(2)加入碳酸钠溶液的目的是除去氯化钙和过量的氯化钡.
II.将精盐水制成饱和溶液,先向其中通入足量的氨气,在向其中通入足量的二氧化碳至有大量晶体(碳酸氢钠,NaHCO3)析出,反应的化学方程式为:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓:将晶体转移出来后,加热至不在有气体产生,所得固体即为纯碱.
(3)加热晶体碳酸氢钠获得纯碱的化学方程式为2NaHCO$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(4)制碱过程中获得的副产品可做化肥,其化学式为NH4Cl.
组成确定
(5)①称取一定质量的纯碱样品,经多次充分加热后,在称重,质量无变化:②另取少量纯碱样品加入适量水,样品完全溶液,向该溶液中加入过量稀HNO3,在滴加AgNO3溶液,有白色沉淀.由上述实验可确定纯碱样品含有杂质NaCl(化学式).
含量确定
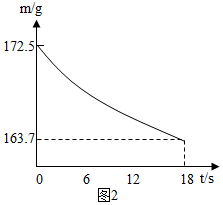
(6)称取纯碱样品21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图2所示.请通过计算并结合下表判断此纯碱样品等级为合格品.
| 工业纯碱标准:(Na2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
(7)某同学认为,在上述纯碱含量测定过程中,如果测得结果比实际纯度高,可能原因是稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大.
| A. | “1”表示硫元素的个数 | |
| B. | “2”表示一个氢分子中的两个氢原子 | |
| C. | “3”表示3个物质 | |
| D. | “4”表示一个分子中的4个氧原子 |
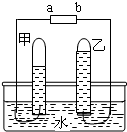 如图是电解水的简易装置.
如图是电解水的简易装置.