题目内容
11.北京时间10月5日下午17时30分,“诺贝尔生理学或医学奖”获奖名单揭晓,来自中国的女药学家屠呦呦获奖,以表彰她发现青蒿素对疟疾治疗所做的贡献.屠呦呦女士也是首位获得诺贝尔科学类奖项的中国女科学家.已知青蒿素的化学式为C15H22O5,试计算.(1)青蒿素中碳、氢、氧元素的质量比为90:11:40;
(2)青蒿素中氧元素的质量分数为多少?(结果精确到0.1%)
(3)28.2g青蒿素中所含氧元素的质量是多少?(精确到0.1g)注:写出计算过程:
分析 (1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析解答.
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
解答 解:(1)青蒿素中碳、氢、氧元素的质量比为(12×15):(1×22):(16×5)=90:11:40;
(2)青蒿素的相对分子质量为12×15+1×22+16×5=282,C15H22O5中氧元素的质量分数为 $\frac{16×5}{282}$×100%≈28.4%.
(4)28.2g C15H22O5中含有氧元素的质量为:28.2g×$\frac{16×5}{282}$×100%=8g.
故答案为:(1)90:11:40;(2)28.4% (3)8g.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
2.为了了解水的组成,某同学提出了电解水的方法,这个环节属于科学探究中的( )
| A. | 提出假设 | B. | 设计实验 | C. | 收集证据 | D. | 作出结论 |
19.下列有关原子、分子的说法错误的是( )
| A. | 物质可以由分子或原子等粒子直接构成,但分子一定是由原子构成的 | |
| B. | 原子、分子总在不断地运动 | |
| C. | 分子可以再分,原子不能再分 | |
| D. | 分子间有一定的间隔 |
3.某制碱厂以海水为主要原料生产纯碱(碳酸钠)和其他副产品.
I.将海水进行处理后获得精盐水.海水中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质.将杂质转化为沉淀过滤除去,在向滤液中加入适量的盐酸得到精盐水,该工艺示意如图1:

(1)对该过程的认识中,不正确的是AC
A.操作①中需要进行搅拌,目的是提高氯化钠的溶解度
B.操作③、④两步顺序可以颠倒
C.操作⑤得到的沉淀中有三种成分的物质
D.操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7
(2)加入碳酸钠溶液的目的是除去氯化钙和过量的氯化钡.
II.将精盐水制成饱和溶液,先向其中通入足量的氨气,在向其中通入足量的二氧化碳至有大量晶体(碳酸氢钠,NaHCO3)析出,反应的化学方程式为:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓:将晶体转移出来后,加热至不在有气体产生,所得固体即为纯碱.
(3)加热晶体碳酸氢钠获得纯碱的化学方程式为2NaHCO$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(4)制碱过程中获得的副产品可做化肥,其化学式为NH4Cl.
组成确定
(5)①称取一定质量的纯碱样品,经多次充分加热后,在称重,质量无变化:②另取少量纯碱样品加入适量水,样品完全溶液,向该溶液中加入过量稀HNO3,在滴加AgNO3溶液,有白色沉淀.由上述实验可确定纯碱样品含有杂质NaCl(化学式).
含量确定
(6)称取纯碱样品21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图2所示.请通过计算并结合下表判断此纯碱样品等级为合格品.
总结反思
(7)某同学认为,在上述纯碱含量测定过程中,如果测得结果比实际纯度高,可能原因是稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大.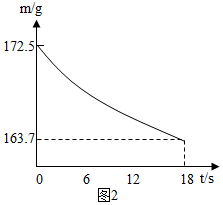
I.将海水进行处理后获得精盐水.海水中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质.将杂质转化为沉淀过滤除去,在向滤液中加入适量的盐酸得到精盐水,该工艺示意如图1:

(1)对该过程的认识中,不正确的是AC
A.操作①中需要进行搅拌,目的是提高氯化钠的溶解度
B.操作③、④两步顺序可以颠倒
C.操作⑤得到的沉淀中有三种成分的物质
D.操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7
(2)加入碳酸钠溶液的目的是除去氯化钙和过量的氯化钡.
II.将精盐水制成饱和溶液,先向其中通入足量的氨气,在向其中通入足量的二氧化碳至有大量晶体(碳酸氢钠,NaHCO3)析出,反应的化学方程式为:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓:将晶体转移出来后,加热至不在有气体产生,所得固体即为纯碱.
(3)加热晶体碳酸氢钠获得纯碱的化学方程式为2NaHCO$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(4)制碱过程中获得的副产品可做化肥,其化学式为NH4Cl.
组成确定
(5)①称取一定质量的纯碱样品,经多次充分加热后,在称重,质量无变化:②另取少量纯碱样品加入适量水,样品完全溶液,向该溶液中加入过量稀HNO3,在滴加AgNO3溶液,有白色沉淀.由上述实验可确定纯碱样品含有杂质NaCl(化学式).
含量确定
(6)称取纯碱样品21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图2所示.请通过计算并结合下表判断此纯碱样品等级为合格品.
| 工业纯碱标准:(Na2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
(7)某同学认为,在上述纯碱含量测定过程中,如果测得结果比实际纯度高,可能原因是稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大.

1.将下列四种物质分别放入水中,能形成溶液的是( )
| A. | 泥土 | B. | 蔗糖 | C. | 氢气 | D. | 汽油 |

 如图是电解水的简易装置.
如图是电解水的简易装置.