题目内容
6.催化剂在生产、生活和科研中有着重要作用.实验室中用过氧化氢分解制氧气,常用MnO2作催化剂.【提出问题】其他物质能作过氧化氢分解的催化剂吗?
【猜想】甲同学认为CuO或Fe2O3可以代替MnO2,因为按物质简单分类MnO2、CuO、Fe2O3都属于氧化物.
【设计实验】甲同学按下面步骤进行实验:
(1)在试管中加入5mL5%的过氧化氢溶液,把带火星的木条伸入试管;
(2)用精密的天平准确称量0.5g Fe2O3红色粉末,并钭其加入另一只试管中;
(3)在步骤(2)的试管中加入5mL5%的过氧化氢溶液,把带火星的木条伸入试管;
(4)待步骤(3)的试管中没有气泡后,再进行“某一操作”将固体洗净、干燥、称量,得红色固体的质量仍为0.5g.
【现象】甲同学观察到步骤(1)中的现象为带火星的木条没有复燃,步骤(3)中带火星的木条复燃.
【反思】步骤(4)中进行的“某一操作”是过滤,乙同学认为在步骤(4)后还需要增加一个实验,请你写出实验的操作方法和现象将得到的Fe2O3再次加入过氧化氢溶液中,过氧化氢溶液能较快产生氧气.
【结论】通过以上实验步骤得出的结论是CuO或Fe2O3也能作过氧化氢分解的催化剂.
分析 根据催化剂在反应中的特点,要想证明某种物质是催化剂,首先,加入这种物质前后反应速率是不是变化非常明显,其次反应前后这种物质的化学性质、质量均不变;如果该物质加入后,化学反应速率发生了明显改变,而自身在反应前后化学性质和质量都没有改变,可证明该物质为此反应的催化剂.
解答 解:[猜想]CuO、Fe2O3、MnO2三种物质均为两种元素组成且含氧元素的氧化物;
[现象]常温下5mL5%的H2O2溶液分解缓慢,放出的氧气不足以使带火星的木条复燃;甲同学观察不到步骤①中伸入的带火星木条的复燃;
[反思]为证明氧化铁作为反应的催化剂,除以上检验加快反应速度外,还需要分离反应后剩余物中的氧化铁,以测定其质量不变.由于反应后氧化铁不溶于水故采用过滤的方式进行分离.
在确认质量不变时,还需要证明分离出来的固体氧化铁的化学性质是否发生了改变,通常采取再利用其做一次相同的催化作用实验;
【结论】通过以上实验可得CuO或Fe2O3也能作过氧化氢分解的催化剂.
故答案是:[猜想]氧化物;
[现象]带火星的木条没有复燃;
[反思]过滤;将得到的Fe2O3再次加入过氧化氢溶液中,过氧化氢溶液能较快产生氧气.
【结论】CuO或Fe2O3也能作过氧化氢分解的催化剂.
点评 此题考查了催化剂及催化作用的实验验证方法,利用实验分别进行了催化剂特性的验证,即化学反应前后催化剂质量没有增减,化学性质不会改变.

练习册系列答案
相关题目
7.如图为硫酸钠和氯化钠的溶解度曲线.下列说法正确的是( )
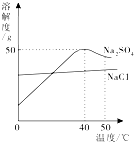

| A. | 温度升高,两种物质的溶解度都增大 | |
| B. | 可用降温结晶的方法提纯含少量Na2SO4的NaCl | |
| C. | 50℃的Na2SO4饱和溶液降到40℃时有晶体析出 | |
| D. | 40℃时,75g饱和Na2SO4溶液中含25g Na2SO4 |
14.合金和纯金属相比,一般来说,除以下( )以外,其余均增强,因此,合金有更广泛的用途.
| A. | 熔点更高 | B. | 硬度 | C. | 抗腐蚀性 | D. | 强度 |
1.小华想测定Cu-Zn合金中铜的质量分数,实验室只提供了一瓶稀盐酸和相关的仪器.为了测定该合金的组成,小华称取10g该合金粉末,在粉末中连续三次加入稀盐酸反应.每加一次盐酸,小华记录所得气体的质量,实验数据如下,从下表数据分析:
①小华用10g合金粉末总共收集到氢气0.20g
②求出该合金中铜的质量分数.(H-1 Cu-64 Zn-65 Ag-108 Cl-35.5)
| 第一次 | 第二次 | 第三次 | |
| 连续加入盐酸的体积/mL | 10 | 10 | 10 |
| 生成氢气的质量/g | 0.08 | 0.08 | 0.04 |
②求出该合金中铜的质量分数.(H-1 Cu-64 Zn-65 Ag-108 Cl-35.5)
11.实验室可用氯酸钾、过氧化氢制取氧气,下列说法错误的是( )
| A. | 两个反应都是分解反应 | |
| B. | 二氧化锰在两个反应中都作催化剂 | |
| C. | 两个反应的条件相同 | |
| D. | 用H2O2制取氧气更方便,且不产生污染物 |
18.淀粉溶液遇碘变蓝色.实验表明,无论是固体碘还是碘蒸气,均能使淀粉溶液变蓝色.这一现象说明( )
| A. | 同种分子质量相等 | B. | 同种分子体积相等 | ||
| C. | 同种分子化学性质相同 | D. | 同种分子运动速度相同 |
15.下列化学方程式正确的是( )
| A. | 2H2O2═2H2O+O2↑ | B. | 4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 | ||
| C. | 2CO+Fe2O3═2Fe+2CO2 | D. | Fe2O3+6HCl═2FeCl2+3H2O |
16.下列各项应用的主要原理表达正确的是( )
| A. | 盐酸除铁锈:FeO3+4HCl═2FeCl2+2H2O | |
| B. | 胆矾治铜:Fe+CuSO4═FeSO4+Cu | |
| C. | 服用Al(OH)3治疗胃酸过多症:2Al(OH)3+3H2SO4═Al2(SO4)3+3H2O. | |
| D. | 工业上制取生石灰:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+H2O |
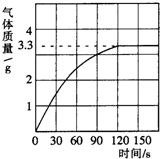 我校科学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,收集12.5g水垢,将足量的质量分数为10%的盐酸加入到水垢中,产生CO2气体的情况如图所示.
我校科学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,收集12.5g水垢,将足量的质量分数为10%的盐酸加入到水垢中,产生CO2气体的情况如图所示.