题目内容
7.如图为硫酸钠和氯化钠的溶解度曲线.下列说法正确的是( )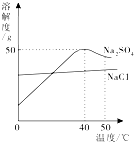
| A. | 温度升高,两种物质的溶解度都增大 | |
| B. | 可用降温结晶的方法提纯含少量Na2SO4的NaCl | |
| C. | 50℃的Na2SO4饱和溶液降到40℃时有晶体析出 | |
| D. | 40℃时,75g饱和Na2SO4溶液中含25g Na2SO4 |
分析 A、根据溶解度曲线可知物质的溶解度随温度变化情况;
B、根据二者的溶解度变化判断提纯物质的方法;
C、根据硫酸钠的溶解度在此温度范围内的变化情况分析解答;
D、根据该温度下硫酸钠的溶解度解答.
解答 解:A、由图可知:硫酸钠的溶解度随温度的升高先增大后减小,故A错误;
B、由于氯化钠的溶解度受温度影响不大,而硫酸钠的溶解度随温度的升高先增大后减小,所以不可用降温结晶的方法提纯含少量Na2SO4的NaCl,故B错误;
C、50℃~40℃硫酸钠的溶解度随温度降低而增大,所以50℃Na2SO4饱和溶液降到40℃时不会有晶体析出,故C错误;
D、40℃时硫酸钠的溶解度是50g,即150g饱和溶液中含有50g硫酸钠,所以75g饱和Na2SO4溶液中含25g Na2SO4,故D正确.
故选:D.
点评 了解溶解度曲线的意义和溶解度概念、分离物质的方法等知识才能正确解答.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案
相关题目
18.下列金属与稀硫酸反应最剧烈的是( )
| A. | 铜 | B. | 镁 | C. | 铁 | D. | 锌 |
15.某一杯长期放置的食盐水,若上部的密度为ag/cm3,则下部的密度为( )
| A. | 大于ag/cm3 | B. | 等于ag/cm3 | C. | 小于ag/cm3 | D. | 无法判断 |
12.下列物质不属于盐的是( )
| A. | KCl | B. | NH4NO3 | C. | KMnO4 | D. | HNO3 |