题目内容
8.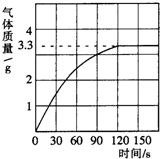 我校科学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,收集12.5g水垢,将足量的质量分数为10%的盐酸加入到水垢中,产生CO2气体的情况如图所示.
我校科学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,收集12.5g水垢,将足量的质量分数为10%的盐酸加入到水垢中,产生CO2气体的情况如图所示.(1)水垢中碳酸钙的质量分数是多少?
(2)假设水垢中除碳酸钙和氢氧化镁外,不含有其它杂质,加入足量的盐酸溶解水垢,测得PH<7,此时溶液的溶质有CaCl2、MgCl2、HCl.(填化学式)
分析 (1)根据反应产生气体的情况图,当反应到120s时放出二氧化碳气体达最大值,为3.3g;放出二氧化碳达最大值时,水垢中碳酸钙完全反应,根据反应的化学方程式,由放出二氧化碳的质量计算出样品中碳酸钙质量,碳酸钙质量与水垢样品质量比可计算水垢中碳酸钙的质量分数;
(2)根据反应的原理及盐酸过量分析.
解答 解:(1)从图中可以看出,表示生成气体的曲线在3.3处成了直线,说明反应已完全,不再有气体生成;产生CO2气体的质量为3.3g
设12.5g水垢中碳酸钙的质量为x,参与反应的HCl的质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.3g
$\frac{100}{x}$=$\frac{44}{3.3.g}$
解之得:x=7.5g,水垢中碳酸钙的质量分数为:$\frac{7.5g}{12.5g}$×100%=60%.
(2)根据反应原理CaCO3+2HCl═CaCl2+H2O+CO2↑及Mg(0H)2+2HCl=MgCl2+2H2O,又因为测得PH<7,盐酸过量,所以溶液的溶质有CaCl2、MgCl2、HCl.
故答案为:(1)60%(2)CaCl2、MgCl2、HCl.
点评 解答此类题时首先明确发生的化学反应,再看曲线的三点:起点、折点和终点,曲线的折点即恰好完全反应,此时放出气体的质量即最大质量这是解答本题的突破口.本题主要考查学生利用化学方程式计算的能力.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
18.下列金属与稀硫酸反应最剧烈的是( )
| A. | 铜 | B. | 镁 | C. | 铁 | D. | 锌 |
3.金属冶炼就是要把金属从化合态变成游离态,使金属氧化物还原成金属单质,如图为有关实验室用一氧化碳还原氧化铜的实验装置,装置乙中的溶液为澄清石灰水,请回答与该实验有关的问题:
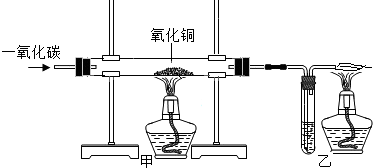
(1)实验时,应先点燃右的酒精灯.(选填“左边”或“右”)
(2)装置乙中发生反应的化学方程式是CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+Cu.
(3)现有含杂质的氧化铜样品10g(假设杂质不参加反应),为测定该样品中氧化铜的质量分数,某同学用如图所示的装置进行实验,得到下列两组数据:
关于这两组数据,下列说法不正确的是BD(选填相关的字母).
A、玻璃管中固体减少的质量即为氧化铜中氧元素的质量
B、利用这两个数据都可以计算出样品中氧化铜的质量分数
C、装置乙中石灰水增重的质量与反应产生二氧化碳的质量不相等
D、如果实验称量很准确,则玻璃管中固体减少的质量应等于装置乙中石灰水增重的质量
(4)通过计算该样品中氧化铜的质量分数为90%.

(1)实验时,应先点燃右的酒精灯.(选填“左边”或“右”)
(2)装置乙中发生反应的化学方程式是CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+Cu.
(3)现有含杂质的氧化铜样品10g(假设杂质不参加反应),为测定该样品中氧化铜的质量分数,某同学用如图所示的装置进行实验,得到下列两组数据:
| 反应前 | 氧化铜完全反应后 | |
| Ⅰ组 | 洗气瓶和石灰水的质量为185g | 洗气瓶和瓶内物质的总质量为187g |
| Ⅱ组 | 玻璃管和氧化铜样品的质量为57.9g | 玻璃管和玻璃管内物质的质量为56.1g |
A、玻璃管中固体减少的质量即为氧化铜中氧元素的质量
B、利用这两个数据都可以计算出样品中氧化铜的质量分数
C、装置乙中石灰水增重的质量与反应产生二氧化碳的质量不相等
D、如果实验称量很准确,则玻璃管中固体减少的质量应等于装置乙中石灰水增重的质量
(4)通过计算该样品中氧化铜的质量分数为90%.
9.在学习酸和碱的性质时发现,任何物质可能对人类有利,也有可能给人类带来危害,如酸或碱也是一样:
| 有利的一面 | 不利的一面 | |
| 示例:CO2 | 可以用于人工降雨 | 导致“温室效应” |
| 酸 | 是工业生产中重要的原料 | 但它又容易混入工业废水中对环境造成污染 |
| 碱 | 可以用于造纸工业 | 但是氢氧化钠具有强烈的腐蚀性,含有氢氧化钠的废水会污染环境 |