题目内容
20.南宁至钦州段的高速铁路正在建设中.请回答下列问题:(1)铁路建设中大量使用了以下材料:①石子;②钢筋水泥柱;③钢轨等,其中钢轨属于A.
A.金属材料 B.合成材料 C.有机天然材料 D.无机非金属材料
(2)建设中,常用铝和氧化铁(Fe2O3)在高温条件下,反应生成熔融状态下的铁单质对钢轨中的缝隙进行焊接.反应的化学方程式为:Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$X+2Fe,则X的化学式为Al2O3,该反应的基本类型是置换反应.
(3)钢轨长时间使用后会生锈.铁锈的主要成分是Fe2O3•xH2O;除铁锈常用的一种试剂是稀盐酸.
(4)请写出防止铁制品锈蚀的两种常用方法:①在表面涂油;②使铁制品表面形成致密的氧化膜.
分析 弄清生活中材料的分类:金属材料、无机非金属材料、合成材料、复合材料,及质量守恒定律的应用.除铁锈和铁防锈的知识和基本反应类型的概念和特点,就能得出本题的正确答案.
解答 解:(1)由于钢筋水泥柱中的钢筋属于金属材料,故填:A;
(2)Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$X+2Fe,反应前含有2个Fe原子,3个O原子,2个Al原子,反应后含有X和2个Fe原子,故X中含有2个Al原子和3个O原子,X是氧化铝,铝和氧化铁在点燃的条件下能生成氧化铝和铁,而且该反应是一种单质与一种化合物起反应生成另一种单质和另一种化合物的反应属于置换反应.故填:Al2O3 ,置换反应;
(3)铁锈(Fe2O3•xH2O)与稀盐酸能反应生成氯化铁和水.故可用盐酸来除锈.故填:稀盐酸;
(4)防锈的原理是让铁与氧气、水隔绝,因此防锈的措施可以是:让铁制品保持干燥;在铁制品表面涂油、刷漆;使铁制品表面形成致密的氧化膜等.
故填:在表面涂油;使铁制品表面形成致密的氧化膜.
点评 主要考查了生活中常见的几种材料及质量守恒定律的应用、铁生锈、除铁锈、铁防锈等方面的知识和基本反应类型的判断,培养学生分析问题、解决问题的能力,难度稍大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列说法正确的是( )
①工业上采用分离液态空气的方法制备氧气和氮气
②氢气等可燃性气体在点燃前要检验气体的纯度
③一般情况下合金的熔点和硬度都比组成合金的纯金属高
④氢氧化钠固体潮解、变质与水蒸气和二氧化碳有关
⑤二氧化碳、二氧化硫、二氧化氮和一氧化碳都是大气污染物.
①工业上采用分离液态空气的方法制备氧气和氮气
②氢气等可燃性气体在点燃前要检验气体的纯度
③一般情况下合金的熔点和硬度都比组成合金的纯金属高
④氢氧化钠固体潮解、变质与水蒸气和二氧化碳有关
⑤二氧化碳、二氧化硫、二氧化氮和一氧化碳都是大气污染物.
| A. | ②③④ | B. | ①②④ | C. | ①③⑤ | D. | ③④⑤ |
15.“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出).

下列有关该方法的叙述中不正确的是( )

下列有关该方法的叙述中不正确的是( )
| A. | 能耗大是该方法的一大缺点 | |
| B. | 整个过程中,有两种物质可以循环利用 | |
| C. | “反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤 | |
| D. | 该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇(CH4O)等产品 |
5.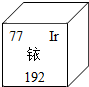 今年央视3.15晚会揭开周大生等品牌黄金制品掺杂铱牟取暴利的内幕.铱元素在周期表中的信息如图所示.下列说法不正确的是( )
今年央视3.15晚会揭开周大生等品牌黄金制品掺杂铱牟取暴利的内幕.铱元素在周期表中的信息如图所示.下列说法不正确的是( )
 今年央视3.15晚会揭开周大生等品牌黄金制品掺杂铱牟取暴利的内幕.铱元素在周期表中的信息如图所示.下列说法不正确的是( )
今年央视3.15晚会揭开周大生等品牌黄金制品掺杂铱牟取暴利的内幕.铱元素在周期表中的信息如图所示.下列说法不正确的是( )| A. | 铱属于金属元素 | B. | 铱的原子序数是77 | ||
| C. | 铱原子的核外电子数为77 | D. | 铱原子相对原子质量是192g |
10.科学家在一定条件下将一氧化碳与氢气合成甲醇(CH3OH),下列说法正确的是( )
| A. | 甲醇为无机物 | |
| B. | 甲醇由碳原子、氧原子、氢原子构成 | |
| C. | 甲醇中碳元素与氢元素的质量比为1:4 | |
| D. | 该合成过程CO和H2的质量比为7:1 |


