题目内容
13.在一堂化学实验课上,老师为每组同学分别提供了一瓶固体氢氧化钠,让大家进行实验探究,请你参与.探究活动一:探究酸碱中和反应
甲组同学按图1所示进行实验
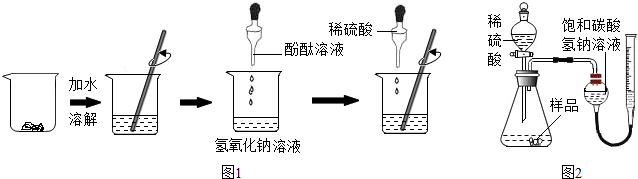
(1)往氢氧化钠溶液中滴入无色酚酞溶液,观察到的现象是溶液变红色,说明溶液呈碱性.
(2)边滴加稀硫酸,边要用玻璃棒不断搅拌的目的是使稀硫酸与氢氧化钠成分混合,发生反应.
(3)当溶液颜色又恰好变为无色时,说明酸能与碱发生反应,测得此时溶液的pH=7.
乙组同学也按上述步骤进行实验,但在滴加稀硫酸时,发现溶液有气泡产生.同学们经讨论一致认为是氢氧化钠发生变质生成了碳酸钠,于是进行如下探究:
探究活动二:测定乙组的氢氧化钠样品(以下简称样品)中碳酸钠的质量分数
资料摘要:Ⅰ.二氧化碳在饱和碳酸氢钠溶液中几乎不溶解
II.碳酸钠溶液与氢氧化钡溶液反应,产生白色沉淀.化学方程式如下:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
【方案一】气体测定法
取一定量的样品与足量稀硫酸在如图2装置中反应,测定产生的二氧化碳的体积.根据该实验条件下二氧化碳的密度计算二氧化碳的质量,再根据相关计算得出样品中碳酸钠的质量分数.
(4)写出稀硫酸与样品中成分反应产生气体的化学方程式Na2CO3+H2SO4=Na2SO4+H2O+CO2↑.
(5)某同学用水代替图2装置中的饱和碳酸氢钠溶液进行收集和测量二氧化碳,发现所测气体的体积偏小,原因是二氧化碳可以溶于水,与水反应.
【方案二】沉淀测定法
小明设计如图所示实验,测定碳酸钠的质量分数.
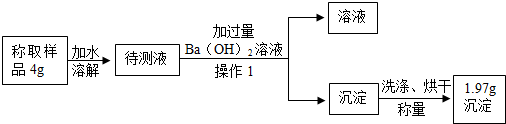
(6)“操作1”的名称是过滤;Ba(OH)2溶液过量的目的是充分除尽溶液中的碳酸钠.
(7)1.97g的白色沉淀是碳酸钡(填物质名称),根据上述提供的实验数据,计算出碳酸钠的质量分数为26.5%.
(8)如果沉淀不洗涤就直接烘干、称量,将导致结果偏高(选填“偏高”、“偏低”或“没影响”).
分析 (1)根据指示剂的变色规律分析,酚酞遇酸性和中性溶液都不变色,遇碱性溶液变红;
(2)根据玻璃棒搅拌的作用分析;
(3)当溶液颜色又恰好变为无色时,说明酸能与碱恰好发生反应;
(4)碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,
(5)根据二氧化碳可以溶于水,与水反应分析;
(6)过滤可将固体与液体分开,加入Ba(OH)2溶液除去剩余的碳酸钠,
(7)氢氧化钡与碳酸钠反应生成碳酸钡和氢氧化钠,根据碳酸钡的质量和方程式分析;
(8)如果沉淀不洗涤就直接烘干、称量,碳酸钡粘附有氢氧化钠等
解答 解:(1)氢氧化钠溶液显碱性,使酚酞变红色;
(2)边滴加稀硫酸,边要用玻璃棒不断搅拌的目的是使稀硫酸与氢氧化钠成分混合,发生反应;
(3)当溶液颜色又恰好变为无色时,说明酸能与碱恰好发生反应,此时溶液的pH=7;
(4)碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,化学方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(5)二氧化碳可以溶于水,与水反应,造成所测气体的体积偏小;
(6)经过操作1后得到了沉淀和滤液,所以操作1的名称是:过滤,足量的氢氧化钡可以将碳酸钠充分的沉淀,所以在加入过量氢氧化钡的目的是:充分除尽溶液中的碳酸钠.
(7)氢氧化钡与碳酸钠反应生成碳酸钡和氢氧化钠,所以1.97g的白色沉淀是碳酸钡;
设碳酸钠的质量分数为x
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
106 197
x×4g 1.97g
$\frac{106}{x×4g}$=$\frac{197}{1.97g}$
x=26.5%
(8)如果沉淀不洗涤就直接烘干、称量,碳酸钡粘附有氢氧化钠等,造成沉淀质量变大,计算出碳酸钠的质量分数偏高.
故答案为(1)溶液变红色;碱;(2)使稀硫酸与氢氧化钠成分混合,发生反应;
(3)=7;(4)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(5)二氧化碳可以溶于水,与水反应(6)过滤;充分除尽溶液中的碳酸钠(7)碳酸钡;26.5%
(8)偏高.
点评 本考点属于物质的分离和提纯,利用流程图中的现象和实验方案的设计,考查同学们的判断能力,同学们只要认真分析,根据条件综合把握,问题就会迎刃而解.

| A. | 喝汽水后打嗝,是因为压强减小气体的溶解度变小 | |
| B. | 踩瘪的乒乓球在热水中复原,说明分子的体积变大了 | |
| C. | 铝制品不容易锈蚀,是因为铝的化学性质不活泼 | |
| D. | 被雨水淋湿的自行车,先用干布擦净后再用带油的布擦 |
| A. | CaCO3 | B. | Ca(HCO3)2 | C. | CaO | D. | Ca(OH)2 |

| A. | 反应物是混合物 | |
| B. | 乙是化合物 | |
| C. | 根据质量守恒定律可推知,1个丙分子中含有2个A原子 | |
| D. | 该化学反应中分子的种类没有发生改变 |
| A. |  | B. |  | C. |  | D. |  |

| A. | ①和②中的铁钉无明显变化,③中的铁钉明显生锈 | |
| B. | ②中加入的蒸馏水要事先煮沸,目的是除去水中溶解的氧气 | |
| C. | ③中铁钉的甲、乙、丙三处,甲处锈蚀最严重 | |
| D. | 探究发现铁生锈的主要条件是铁与空气和水(火或水蒸气)直接接触 |
 实验小组在室温下将盐酸滴入盛有氢氧化钠溶液的烧杯中,用温度计测量溶液温度,结果如图所示.
实验小组在室温下将盐酸滴入盛有氢氧化钠溶液的烧杯中,用温度计测量溶液温度,结果如图所示.
