题目内容
6.连云港碱厂年产纯碱120万吨,是我国三大纯碱生产企业之一.它的产品除了纯碱外,还有氯化钙和碳酸氢钠.该厂生产纯碱的工艺流程可简单表示如图1: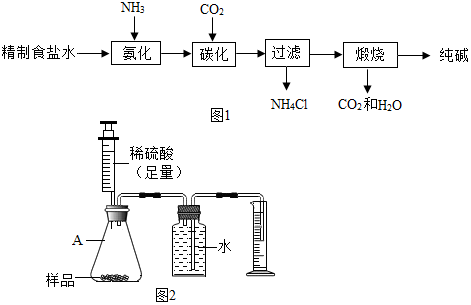
其生产过程中涉及的主要化学反应有:
①NaCl+NH3+CO2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH4Cl+NaHCO3↓
②2NaHCO3═Na2CO3+CO2↑+H2O
请回答:
(1)①“碳化”过程中需要的CO2,可由石灰石高温煅烧得到,该反应的化学方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
②实验室中,通常用稀盐酸与石灰石反应制取CO2气体,不选用浓盐酸的理由是浓盐酸具有挥发性,使制得的气体不纯;干燥CO2气体,可用的干燥剂是A(填字母).
A.浓硫酸 B.固体氢氧化钠 C.生石灰
(2)①该厂“过滤”所得的NH4Cl可作化肥中的氮肥,它也可与Ca(OH)2在加热时发生反应生成产品CaCl2,同时还有NH3和H2O生成,写出该反应的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
该厂的另一种产品碳酸氢钠俗称小苏打,它的重要用途有治疗胃酸过多(只写一种).
②实验室进行“过滤”操作时,下列说法正确的有BD(填字母)
A.使用的漏斗叫长颈漏斗 B.液面应低于滤纸边缘
C.玻璃棒应不停搅拌 D.漏斗下端的管口要紧靠烧杯内壁
(3)某化学兴趣小组的同学为了测定该厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),设计了如下两种实验方案:
方案一:称取样品10.65g,加水完全溶解,向其中加入足量的氯化钡溶液,充分反应后,过滤、洗涤,干燥得固体19.70g.通过计算(写出计算过程)判断该厂的产品是否属于优等品属于优等品.(杂质可溶于水且不与氯化钡反应)
方案二:用图2所示的装置,通过准确测量排出水的体积,也可计算样品的纯度.该装置中仪器A的名称是锥形瓶,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是部分二氧化碳溶于水,导管中有水等.(装置的气密性良好)
分析 (1)高温条件下,碳酸钙分解生成氧化钙和二氧化碳;
浓盐酸易挥发;
二氧化碳不能和浓硫酸反应,可以用浓硫酸干燥二氧化碳;
(2)氯化铵中含有氮元素,可以用作氮肥;
加热条件下,氯化铵和氢氧化钙反应生成氯化钙、水和氨气;
碳酸氢钠俗称小苏打,它的重要用途有治疗胃酸过多,用作发酵粉等;
实验室进行“过滤”操作时,液面应低于滤纸边缘,漏斗下端的管口要紧靠烧杯内壁;
(3)碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:(1)①高温条件下,碳酸钙分解生成氧化钙和二氧化碳,该反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
故填:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
②实验室中,通常用稀盐酸与石灰石反应制取CO2气体,不选用浓盐酸的理由是浓盐酸具有挥发性,使制得的气体不纯;
干燥CO2气体,可用的干燥剂是浓硫酸,不能用氢氧化钠和氧化钙,这是因为二氧化碳能和氢氧化钠反应生成碳酸钠和水,氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水.
故填:浓盐酸具有挥发性,使制得的气体不纯;A.
(2)①该厂“过滤”所得的NH4Cl可作化肥中的氮肥,它也可与Ca(OH)2在加热时发生反应生成产品CaCl2,同时还有NH3和H2O生成,该反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
该厂的另一种产品碳酸氢钠俗称小苏打,它的重要用途有治疗胃酸过多,用作发酵粉等.
故填:氮;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;小苏打;治疗胃酸过多.
②实验室进行“过滤”操作时,下列说法正确的有液面应低于滤纸边缘,漏斗下端的管口要紧靠烧杯内壁.
故填:BD.
(3)方案一:
解:设碳酸钠的质量为x,
Na2CO3+BaCl2=BaCO3↓+2NaCl
106 197
x 19.70g
$\frac{106}{x}$=$\frac{197}{19.70g}$,
x=10.60g,
该厂产品中碳酸钠的质量分数为:$\frac{10.60g}{10.65g}$×100%=99.5%,
99.5%>99.2% 属于优等品.
故填:属于优等品.
方案二:
该装置中仪器A的名称是锥形瓶;但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是部分二氧化碳溶于水,导管中有水等.
故填:锥形瓶;部分二氧化碳溶于水,导管中有水等.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

 阅读快车系列答案
阅读快车系列答案 根据如图提供的几种物质的溶解度曲线,判断下列说法正确的是( )
根据如图提供的几种物质的溶解度曲线,判断下列说法正确的是( )| A. | 氯酸钾中混有少量氯化钠,提纯氯酸钾最好用蒸发结晶的方法 | |
| B. | 30℃氯酸钾饱和溶液的溶质质量分数为10% | |
| C. | 80℃时7gNaCl和20g水能形成饱和溶液 | |
| D. | 控制温度,图中氯酸钠和氯化钾能发生化学反应 |
| A. | Y>X>Z | B. | X>Z>Y | C. | Y>Z>X | D. | Z>X>Y |
| A. | 碳酸盐与稀盐酸反应能产生气体,所以与稀盐酸反应产生气体的物质一定是碳酸盐 | |
| B. | 碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液都是碱性溶液 | |
| C. | 燃烧一般都伴随发光、放热现象,所以有发光、放热现象的变化就是燃烧 | |
| D. | 中和反应一定有盐和水生成,所以有盐和水生成的反应一定是中和反应 |
 镁是一种活泼金属,除了能与氧气反应,还可以与氮气、二氧化碳等反应.为测定镁铝合金(不含其他元素)中镁的质量分数,称量ag镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧.下列关于该实验的说法正确的是( )
镁是一种活泼金属,除了能与氧气反应,还可以与氮气、二氧化碳等反应.为测定镁铝合金(不含其他元素)中镁的质量分数,称量ag镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧.下列关于该实验的说法正确的是( )

