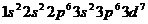2.(银川一中2009届高三年级第四次月考理综)
元素A-D是元素周期表中短周期的四种元素,请根据表中的信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
物质或结构信息 |
单质制成的的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构 |
单质常温、常压下是气体,原子的L层有一个未成对的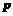 电子 电子 |
+2价阳离子的核外电子排布与氖原子相同。 |
(1)上表中与A属于同一周期的元素是_____________(写元素符号) ,写出D离子的电子排布式______________________。
(2)D和C形成的化合物属于_________晶体 。写出C单质与水反应的化学方程式_________________________ 。
(3)对元素B的单质或化合物描述正确的是_________。
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下镁条能与单质B反应
(4)A和D两元素金属性较强的是(写元素符号)__ ___。 写出能证明该结论的一个实验事实___________ _____。
[解析]A单质制成的的高压灯,发出的黄光透雾力强、射程远。A为Na;B工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构,B可能为N或O; C单质常温、常压下是气体,原子的L层有一个未成对的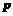 电子,C为F;D+2价阳离子的核外电子排布与氖原子相同,D为Mg。
电子,C为F;D+2价阳离子的核外电子排布与氖原子相同,D为Mg。
[答案](1)Mg;
1s22s22s6。 (2)离子; 2F2+2H2O 4HF+O2.
4HF+O2.
(3)b;d(B是氧气或氮气)。
(4)Na;钠与水反应比镁与水反应激烈或氢氧化钠的碱性比氢氧化镁强
 (2)CS2是一种重要的有机溶剂,CS2分子的空间构型为
;写出一种与CS2互为等电子体的物质的化学式
;
(2)CS2是一种重要的有机溶剂,CS2分子的空间构型为
;写出一种与CS2互为等电子体的物质的化学式
;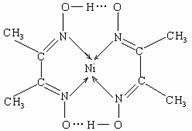 铅、锌,居有色金属第五位,镍行业发展蕴藏着巨大的潜力。
铅、锌,居有色金属第五位,镍行业发展蕴藏着巨大的潜力。 (3)很多不饱和有机物在Ni催化下可与H2发生加成反应。如①CH2=CH2、②HC≡CH、③ ④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。如①CH2=CH2、②HC≡CH、③ ④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序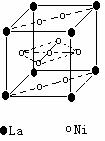 号),预测HCHO分子的立体结构为
形。
号),预测HCHO分子的立体结构为
形。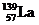 ) 和镍(
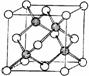
) 和镍( ) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。 E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
 LaNi5H6;(2)CE(3)①[Ar]3d7;或
LaNi5H6;(2)CE(3)①[Ar]3d7;或